26.在标准状况下,将CO和CO2混合气体共0.1mol,充入盛有3.9gNa2O2的密闭容器中,然后用电火花不断引燃容器内的气体混合物充分反应。若CO2在混合气体中所占的物质的量分数为x。试通过分析和计算,得出x值与剩余气体关系的几种情况,将结果填写在下表中。
|
X值 |
剩余气体 |
|
|
化学式 |
物质的量 |
|
|
|
|
|
25.合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
⑴1m3(标准状况)CH4按上式完全反应,产生H2 mol。
⑵CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
⑶CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
|
气体 |
CO |
H2 |
N2 |
O2 |
|
体积(L) |
25 |
60 |
15 |
2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
⑷若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
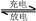 H2+2NiO(OH)。根据此反应式判断,下列叙述中正确的是
( )
H2+2NiO(OH)。根据此反应式判断,下列叙述中正确的是
( )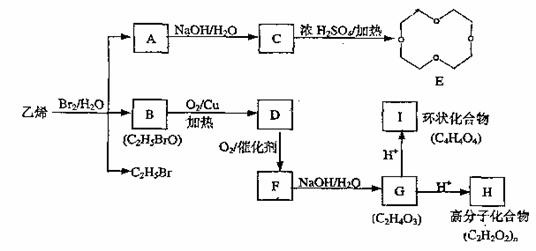
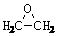 )的结构可简写为
)的结构可简写为 则E的分子式是 。
则E的分子式是 。