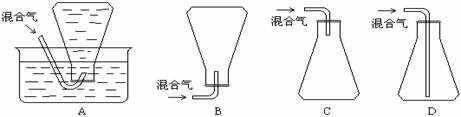
5.NaF,Nal,MgO均为离子化合物,根据下列数据,这
三种化合物的熔点高低顺序是 ( )
|
物质 |
①NaF |
②NaI |
③MgO |
|
离子电荷数 |
1 |
1 |
2 |
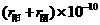 m m |
2.31 |
3.18 |
2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
65、工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
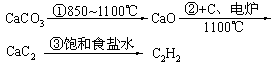 |
|
乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛________________________________________________________。
b.乙烯氧化法制乙醛________________________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:______________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
________________________________________________________________________。
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率_______(填增大、减小、不变);而实际生产中不采用的理由是____________________________ _。
(5)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
63、参看表格内容,回答下列问题:
|
物质 |
外观 |
在空气中加热时的现象 |
产物水溶液的酸碱性 |
|
X |
黑色粉未 |
燃烧时呈炽红色并发出火花,放出无色气体G |
微弱酸性 |
|
Y |
淡黄色晶体 |
首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 |
弱酸性 |
|
Z |
银白色固体 |
燃烧,产生黄色火焰,生成浅黄色固体F |
强碱性 |
⑴X、Y、Z、F分别是(写名称) 、 、 、 。
⑵G中的化学键 (填“有”或“没有”)极性。G在固态时属于 晶体
⑶Y和Z直接作用后的生成物属于 晶体。写出它的电子式 。
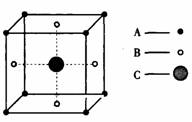 C. 室温为固体 D.室温为气体
C. 室温为固体 D.室温为气体 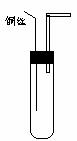 (1) 完成下列实验步骤:
(1) 完成下列实验步骤: