2.常见阳离子检验
|
离子 |
试剂或方法 |
现 象 |
离子方程式 |
|
H+ |
石蕊
甲基橙
Na2CO3 |
蓝色→红色
橙色→红
有气泡 |
2H++CO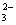 =H2O+CO2↑ =H2O+CO2↑ |
|
K+ |
焰色反应 |
浅紫色火焰(秀过蓝色钴玻璃) |
1 |
|
Na+ |
焰色反应 |
黄色火焰 |
1 |
NH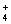 |
加OH-,加热 |
有气体产生使润湿的红色石蕊度纸变蓝;
遇沾有浓HCl的玻璃有白烟 |
NH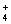 +OH- +OH-  NH3↑+2H2O+NH3+HCl=NH4Cl NH3↑+2H2O+NH3+HCl=NH4Cl |
|
Ag+ |
加Cl-,稀HNO3 |
白色沉淀,不溶于稀HNO3 |
Ag2++Cl-=AgCl↓ |
|
Mg2+ |
NaOH溶液 |
白色沉淀,碱过量沉淀不溶 |
Mg2++2OH-=Mg(OH)2↓ |
|
Ba2+ |
加入稀H2SO4 |
白色沉淀 |
Ba2++SO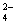 =BaSO4↓ =BaSO4↓ |
|
Fe2+ |
加NaOH |
白色沉淀→灰绿色→红褐色 |
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
|
加KSCN和氯水 |
无现象,再加氯水溶液变红色 |
2Fe2++Cl2=2Fe3++2Cl-
Fe3++SCN-=[Fe(SCN)]2+ |
|
|
Cu2+ |
加NaOH |
蓝色沉淀 |
Cu2++2OH-=Cu(OH2)2↓ |
|
Al3+ |
加NaOH |
先生成白色沉淀,OH-过量白色沉淀溶解 |
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO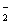 +2H2O +2H2O |
|
Fe3+ |
加NaOH |
红褐色沉淀 |
Fe3++3OH-=Fe(OH)3↓ |
|
加KSCN |
变红色 |
Fe3++SCN-=[Fe(SCN)]2+ |
|
|
加苯酚 |
溶液显紫色 |
Fe3++6(C6H5OH)=[Fe(C6H5O)]3+6H+ |
1.常见气体的检验
|
气体 |
常用的反应和现象 |
注意问题 |
|
空气 |
木条能燃,但不能使带火星的木条复燃 |
NO2
N2O气体也能“助燃” |
|
O2 |
能使带火星的木条复燃 |
|
|
H2 |
点燃火焰呈浅蓝色,只生成H2O,不纯者点燃有爆鸣声 |
①点燃可燃性气体时一定要验纯
②用玻璃导管点燃有时看不到蓝色火焰,因Na+燃烧有黄色火焰 |
|
CO |
点燃火焰呈蓝色,生成物只有CO2 |
|
|
H2S |
点燃火焰呈蓝色,不完全燃烧生成硫;遇Pb(Ac)2,或Pb(NO3)2湿试纸变黑,有臭鸡蛋味 |
|
|
CH4 |
点燃火焰呈浅蓝色,生成CO2或水;不使溴水或KMnO4酸性溶液褪色 |
③遇到多种可燃性气体除点燃外,还要利用特征或燃烧产物的性质加以区别(如H2S有臭鸡蛋味,也能使溴水褪色或KMnO4酸性溶液褪色,但有硫沉淀)。 |
|
C2H4 |
点燃火焰较高,有微黑烟;使溴水或酸性KMnO4溶液褪色 |
|
|
C2H2 |
点燃,火焰明亮有较浓黑烟;使溴水或酸性KMnO4溶液褪色 |
|
|
NH3 |
使湿润红色石蕊试纸变蓝,遇蘸浓盐酸的玻璃棒有白烟 |
在空气中不燃,但在纯氧中可燃,
4NH3+3O2(纯)=2N2+6H2O |
|
NO |
开瓶盖或遇空气立即变成红棕色 |
NO在空气中不存在 |
|
NO2 |
红棕色,但溶于水为无色溶液,遇AgNO3溶液无沉淀;使蓝色石蕊试纸变红 |
两者都能使KI-淀粉试纸变蓝,不能用它区别(O3也能) |
|
Br2蒸气 |
溶于水成橙黄色溴水,与AgNO3溶液出浅黄色沉淀;使蓝色石蕊试纸变红 |
|
|
Cl2 |
黄绿色,使KI-淀粉湿试纸变蓝;使品红湿试纸褪色 |
与石灰水无沉淀 |
|
SO2 |
使澄清石灰水出现白色沉淀后澄清,使品红溶液褪色,加热后恢复原色,使酸性KMnO4溶液或溴水褪色 |
①SO2具有刺激性气体、CO2无气味,它们都可使石蕊由蓝变红,SO2更显著,不用此鉴别
②SO2和CO2通入石灰水的现象一样 |
|
CO2 |
使澄清石灰水出现白色沉淀后澄清,但不使品红溶液KMnO4酸性溶液溴水等溶液褪色 |
|
|
HCl |
使湿润蓝色石蕊试纸变红,遇蘸氨水的玻璃棒出白烟,遇AgNO3溶液白色沉淀 |
HI、HBr气体同HCl,但遇AgNO3溶液分别出AgI, AgBr的黄色及浅黄色沉淀 |
|
N2 |
不发生上述所有情况或现象 |
只有镁能在其中点燃生成Mg3N2 |
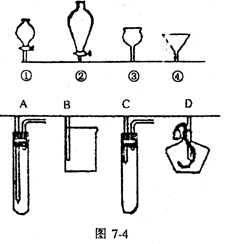
3.常见气体制备原理,装置选择
|
气体 |
反应原理 |
发生
装置 |
收集
装置 |
注意事项 |
|
O2 |
2KMnO4  +MnO2+O2↑
2KClO3 +MnO2+O2↑
2KClO3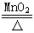 2KC+3O↑ 2KC+3O↑ |
A |
a或b |
共同点:
①气密性的检查
②试管口稍向下倾斜
③若用排水法,做完实验先撤导气管,后撤酒精灯
不同点:
收集氨气仪器要干燥 |
|
CH4 |
无水CH3COONa和碱石灰共热
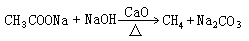 |
A |
a或c |
|
|
NH3 |
2NH4Cl+Ca(OH)2 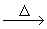 2NH3↑+2H2O+CaCl2 2NH3↑+2H2O+CaCl2 |
A |
c |
|
|
H2 |
较活泼金属(如Zn, Fe)与稀强酸(如H2SO4, HCl但勿用HNO3或浓H2SO4)的置换反应 |
C |
a或c |
①用长颈漏斗时要液封
②制SO2(Na2SO3粉末)、NO2(剧烈放热多)、C2H2(CaC2遇H2O粉化)不能用启普发生器
③制CO2不用H2SO4(因CaSO4微溶)
④制H2S不能用硝酸或浓H2SO4(防氧化) |
|
CO2 |
CaCO3+2HCl=CaCl2+CO2↑+H2O |
C |
b |
|
|
SO2 |
无水Na2SO3粉与中等浓度H2SO4进行复分解反应 |
B |
b |
|
|
NO2 |
Cu和浓HNO3
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O |
B |
b |
|
|
C2H2 |
电石与水进行反应
CaC2+2H2O=Ca(OH)2+C2H2↑ |
B |
a |
|
|
Cl2 |
MnO4+4HCl(浓)  MnO2+Cl2↑+2H2O
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2NaCl+MnO2+2H2SO4 MnO2+Cl2↑+2H2O
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2NaCl+MnO2+2H2SO4  Na2SO4+MnSO4+Cl2↑+2H2O Na2SO4+MnSO4+Cl2↑+2H2O |
E或D |
a或b |
①排水法完毕应先撤导管后撤火
②反应物都是液体要加碎瓷片防爆沸
③制乙烯要控制温度在170℃
④收集Cl2可用排饱和食盐水 |
|
HCl |
食盐与浓H2SO4(不挥发性酸与挥发性酸的盐)进行复分解反应 |
E或D |
b |
|
|
NO |
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
E |
a |
|
|
C2H4 |
 |
F |
a |
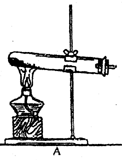
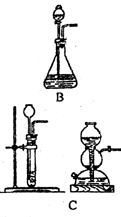
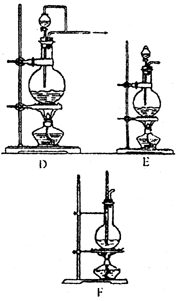
1.气体的发生装置 一般根据反应物状态和反应条件设计气体发生装置,通常气体的发生装置有如下几种(见下图)
|
固态反应物加热产生气体 |
有液体反应物不加热产生气体 |
有液体反应物加热产生气体 |
 |
 |
 |
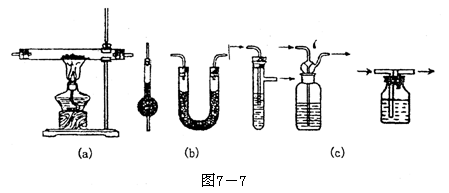 (1)洗气瓶(如图c)中一般装入液体除杂试剂。除杂试剂应通过化学反应将杂质吸收或将杂质气体转化为所制取的气体。常见除杂试剂有:
①强碱溶液:如NaOH溶液可吸收CO2、SO2、H2S、Cl2、NO2等呈酸性的气体。
②饱和的酸式盐溶液,可将杂质气体吸收转化,如:
饱和NaHCO3溶液能除去CO2中混有的HCl、SO2等强酸性气体
饱和NaHSO3溶液能除去O2中混有HCl、SO3等气体
饱和NaHS溶液能除去H2S中混有的HCl气体
③浓H2SO4:利用它的吸水性,可除去H2、SO2、HCl、CO、NO2、CH4等气体中混有的水蒸气。但由于浓H2SO4有强氧化性,不能用来干燥具有强还原性气体:如H2S、HBr、HI等。
④酸性KMnO4溶液:利用它的强氧化性,可以除去具有还原性的气体,如除去混在CO2气体中的SO2、H2S等。
(2)干燥管、U形管一般装入固体的干燥剂。常见的固体干燥剂有:
①酸性干燥剂,用来干燥酸性气体。如P2O5、硅胶、浓H2SO4等。
②碱性干燥剂,用来干燥碱性气体。如CaO、碱石灰等。
③中性干燥剂、既能干燥碱性气体又能干燥酸性气体。如CaCl2(但CaCl2不能干燥NH3,因易形成CaCl2·8NH3合物)。
(3)双通加热管一般装入固体除杂剂,除杂试剂和混和气体中的某一组份反应。例如:Cu和混和气体中O2反应而将O2除去。
(1)洗气瓶(如图c)中一般装入液体除杂试剂。除杂试剂应通过化学反应将杂质吸收或将杂质气体转化为所制取的气体。常见除杂试剂有:
①强碱溶液:如NaOH溶液可吸收CO2、SO2、H2S、Cl2、NO2等呈酸性的气体。
②饱和的酸式盐溶液,可将杂质气体吸收转化,如:
饱和NaHCO3溶液能除去CO2中混有的HCl、SO2等强酸性气体
饱和NaHSO3溶液能除去O2中混有HCl、SO3等气体
饱和NaHS溶液能除去H2S中混有的HCl气体
③浓H2SO4:利用它的吸水性,可除去H2、SO2、HCl、CO、NO2、CH4等气体中混有的水蒸气。但由于浓H2SO4有强氧化性,不能用来干燥具有强还原性气体:如H2S、HBr、HI等。
④酸性KMnO4溶液:利用它的强氧化性,可以除去具有还原性的气体,如除去混在CO2气体中的SO2、H2S等。
(2)干燥管、U形管一般装入固体的干燥剂。常见的固体干燥剂有:
①酸性干燥剂,用来干燥酸性气体。如P2O5、硅胶、浓H2SO4等。
②碱性干燥剂,用来干燥碱性气体。如CaO、碱石灰等。
③中性干燥剂、既能干燥碱性气体又能干燥酸性气体。如CaCl2(但CaCl2不能干燥NH3,因易形成CaCl2·8NH3合物)。
(3)双通加热管一般装入固体除杂剂,除杂试剂和混和气体中的某一组份反应。例如:Cu和混和气体中O2反应而将O2除去。
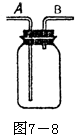 另外还常用固体的无水CuSO4装入干燥管中,通过颜色变化检验水蒸气的存在。用Na2O2固体也可将CO2、H2O(气)转化为O2。
另外还常用固体的无水CuSO4装入干燥管中,通过颜色变化检验水蒸气的存在。用Na2O2固体也可将CO2、H2O(气)转化为O2。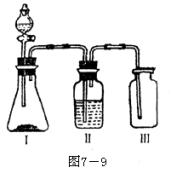 例6.7-9图是一套实验室制气装置,用于发生、干燥和收集气体。下列各物质中能利用这套装置进行实验的是
A.铜屑和稀硝酸
B.二氧化猛和浓盐酸
C.电石和水
D.碳酸钙和稀盐酸
E.硫化亚铁和稀硝酸
例6.7-9图是一套实验室制气装置,用于发生、干燥和收集气体。下列各物质中能利用这套装置进行实验的是
A.铜屑和稀硝酸
B.二氧化猛和浓盐酸
C.电石和水
D.碳酸钙和稀盐酸
E.硫化亚铁和稀硝酸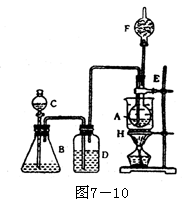 打开分液漏斗C,将浓硫酸缓缓加进B,则D瓶的出气管口不断产生气体,几分钟后烧瓶A中的硫酸铜变蓝色,若此时用水浴加热,F端排出的气体待纯净后还能点燃,产生特殊颜色的火焰,已知C2H5OH沸点为78.5℃,C2H5Cl沸点为12.27℃,请回答:
(1)B中逸出的气体是____________________
(2)D瓶的作用是________________________
(3)A瓶内硫酸铜的作用是________________
(4)E导管的作用是______________________
(5)F口可点燃的气体是__________________
(6)A中发生效应的化学方程式____________
打开分液漏斗C,将浓硫酸缓缓加进B,则D瓶的出气管口不断产生气体,几分钟后烧瓶A中的硫酸铜变蓝色,若此时用水浴加热,F端排出的气体待纯净后还能点燃,产生特殊颜色的火焰,已知C2H5OH沸点为78.5℃,C2H5Cl沸点为12.27℃,请回答:
(1)B中逸出的气体是____________________
(2)D瓶的作用是________________________
(3)A瓶内硫酸铜的作用是________________
(4)E导管的作用是______________________
(5)F口可点燃的气体是__________________
(6)A中发生效应的化学方程式____________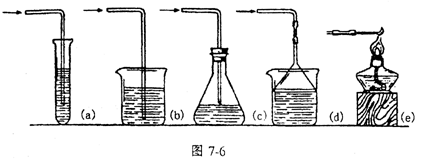 一般常用吸收液吸收这些有害气体,a、b为溶解度不是很大的尾气处理装置,c、d为溶解度大且吸收速率很快的尾气处理装置,难以吸收的尾气如CO,应于末端燃烧除去,如e。此处还可以用塑料袋盛装尾气。
一般常用吸收液吸收这些有害气体,a、b为溶解度不是很大的尾气处理装置,c、d为溶解度大且吸收速率很快的尾气处理装置,难以吸收的尾气如CO,应于末端燃烧除去,如e。此处还可以用塑料袋盛装尾气。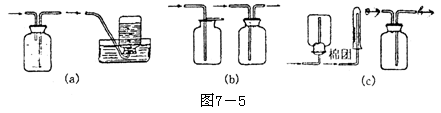
 2H2O
D中:N2+3H2
2H2O
D中:N2+3H2  2NH3
(4)碱石灰(或生石灰、氢氧化钠固体)吸收气体中少量的水蒸气和盐酸酸雾。
2NH3
(4)碱石灰(或生石灰、氢氧化钠固体)吸收气体中少量的水蒸气和盐酸酸雾。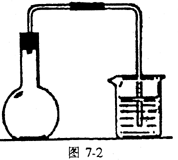
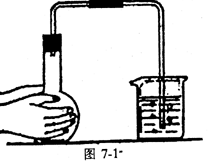 用试管、烧瓶作气体发生器时,应将导气管的末端浸入水中,用双手捂住反应器的外壁或微热反应器。若有气泡产生,移开手掌或热源,过一会儿,有水进入导管形成一段水柱,则证明气密性良好。
用启普发生器作气体发生器时,应将导管活塞关闭,往启普发生器球形漏斗中注满水,静置一段时间后,观察到水面不下降,则说明气密性良好。
如气体实验的装置较多,也可考虑用分段检查的方法、原理与上述相同。
用试管、烧瓶作气体发生器时,应将导气管的末端浸入水中,用双手捂住反应器的外壁或微热反应器。若有气泡产生,移开手掌或热源,过一会儿,有水进入导管形成一段水柱,则证明气密性良好。
用启普发生器作气体发生器时,应将导管活塞关闭,往启普发生器球形漏斗中注满水,静置一段时间后,观察到水面不下降,则说明气密性良好。
如气体实验的装置较多,也可考虑用分段检查的方法、原理与上述相同。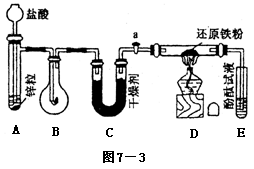 示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U型管。a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,发生氢气。经必要的“操作”[见问题(2)]后,在导管出口处点燃氢气,然后如图所示套上烧瓶B,塞瓶塞,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性?______________。
(2)点燃氢气前必须进行___________操作,进行该操作的方法是___________。
(3)写出B、D中分别发生反应的化学方程式。
B中______________________________
D中______________________________
(4)C中所盛干燥剂的名称是_________;该干燥剂的作用是______________________。
示意图中A是简易的氢气发生器,B是大小适宜的圆底烧瓶,C是装有干燥剂的U型管。a是旋转活塞,D是装有还原铁粉的反应管,E是装有酚酞试液的试管。
实验前先检查实验装置的气密性。实验开始时,先关闭活塞a,并取下烧瓶B,向A中加入一定量浓度适当的盐酸,发生氢气。经必要的“操作”[见问题(2)]后,在导管出口处点燃氢气,然后如图所示套上烧瓶B,塞瓶塞,气体在烧瓶中继续燃烧。用酒精灯加热反应管D中的还原铁粉,待B中氢气的火焰熄灭后,打开活塞a,气体通过反应管D进入试管E中,使酚酞试液呈红色。请回答下列问题。
(1)实验前如何检查装置的气密性?______________。
(2)点燃氢气前必须进行___________操作,进行该操作的方法是___________。
(3)写出B、D中分别发生反应的化学方程式。
B中______________________________
D中______________________________
(4)C中所盛干燥剂的名称是_________;该干燥剂的作用是______________________。