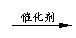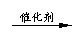例1 下列所指物质属于纯净物的是( )
A. 分子式为C2H4Cl2的物质
B. 含Fe为72.41%的铁的氧化物
C. 常温下的二氧化氮
D. 按体积比为1:1混合NH3和HCl(同条件)
解析: A. 必须考虑同分异构现象,这在有机物中极为普遍, C2H4Cl2可代表1,1-二
氯乙烷和1,2-二氯乙烷.在无机物中一些固体非金属常直接用元素符合 表示.如C,S,P可代表碳,硫,磷的各种同素异形体,故这些符号均不明确所指物质, 不能认为一定是纯净物.
B. 铁的氧化物有FeO、Fe3O4、Fe2O3, 纯净的Fe3O4中Fe%为72.41%.但当
nFeO:nFe2O3=1:1时,所得混合物中Fe%也为72.41%.故不确定.但若题为
含Mg 60%的氧化镁是否属于纯净物呢?因氧化镁只有一种MgO,根据化学
式所求的Mg%与题供数据相同,则是属于纯净物.
 C. 考虑可逆反应2NO2
C. 考虑可逆反应2NO2  N2O4,即可知道常温下不可能为纯净物,又如:
N2O4,即可知道常温下不可能为纯净物,又如:
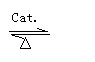
在加热,催化剂存在条件下,将SO2和O2按2:1混合。2SO2+O2 2SO3.因可逆,不可能完全转化为SO3.
D.考虑反应的完全程度、反应物的量及产物的种类.在此NH3+HCl=NH4Cl.故所得产物为纯净物.还值得注意的是题中是否提供反应条件.如常况下的氢氯混合气与氢氟混合气.因H2与Cl2反应必须强光或点燃,而H2与F2在冷暗处即可
例2 .科学家根据自然界存在的N2制取出N3,1998年底又制取了N5,1999年合成和分离了含高能量的N5+离子的化合物。最近科学家确认还存在着另一种足球分子N60。N5极不稳定,需保存在-80℃的干冰中;N5+离子由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在一瞬间释放出来。
(1)下列说法中不正确的是 ( )
A.N5常温下会剧烈爆炸,体积急剧膨胀,放出大量的热
B. N60的发现开辟了能源世界的新天地,将来会成为很好的火箭燃料
C. N2、N3、N5、N5+、N60互为同素异形体
D.含N5+离子的化合物中既有离子键又有共价键
(2) 假如你是一个科学假,想设计用N5作火箭燃料发射火箭,需要解决的主要问题是________
解析:(1)同素异形体研究的对象是单质,N2、N3、N5、N60互为同素异形体,而N5+是一种离子,与它们不属于同素异形体。故C选项错误。
N5+离子是一种带电的原子团,原子团内部一定含有共价键,又含N5+离子的化合物中一定还有阴离子,阴、阳离子之间一定存在离子键的作用。故D选项正确。
(2) ① 怎样制得N5,并防止发生爆炸
②如何保存N5,如用何种容器?
③与传统燃料相比,成本如何?
例3. 已知x和y均是短周期元素中的同族元素的单质,W、V是化合物,它们有如下反应(系数,条件均略去):W+X→Y+V.试写出符合题意,且满足下列要求的化学方程式:
(1)W是水_________________________________________
(2)V是水___________________________________________
(3)W、V都是氧化物____________________________________
解析:由已知条件可得W + X → Y + V
反应为置换反应,从已学过的置换反应和水的特点入手.
 H2:M(金属) + H2O →
M(OH)n + H2↑??
H2:M(金属) + H2O →
M(OH)n + H2↑??
(1)  H2O作反应物
H2O作反应物
O2:F2 + H2O → HF + O2?
因为金属是与H同主族且为短周期元素,则不难搜寻M为Na.
H2:H2 + 金属氧化物 → 金属 + H2O?
(2) 
 H2O作产物???
H2O作产物???
 2H2S + O2 = 2S + 2H2O
2H2S + O2 = 2S + 2H2O
O2: 4HI + O2 = 2I2 + 2H2O
因为符合条件的只有H2S和O2的置换反应.
|

 ①2Mg +CO2 2MgO + C
①2Mg +CO2 2MgO + C

|
|
因为X和Y为同主族元素.所以只有③满足
答案:(1)2Na + 2H2O = 2NaOH + H2↑
 (2)2H2S
+ O2 = 2S + 2H2O
(2)2H2S
+ O2 = 2S + 2H2O
|
例4.将总质量为98.4g的FeCl2、CuCl2和NaBr三种固体的混合物溶于水后,通入足量的Cl2加热蒸发至干后称量残余固体,固体增重5.3g,再将残余固体溶于水,插入铁棒充分反应后,测得铁棒减轻9.6g.求原混和物中FeCl2的物质的量的百分含量.
解: 本题涉及到四个反应,其中两个“化合”、两个“置换”题目提供了前后
质量的改变值.故可采用差量法.但请注意每一结果有两个相反因素.
设混合物中FeCl2为Xmol、CuCl2为Ymol,NaBr为Zmol
127X+135Y+103Z=98.4 (1)
2FeCl2+Cl2=2FeCl3 增重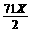 g
g
2NaBr+Cl2=2NaCl+Br2 减轻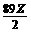 g
g
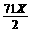 -
-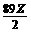 =5.3 (2)
=5.3 (2)
2FeCl3+Fe=3FeCl2 减轻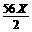 g
g
CuCl2+Fe=Cu+FeCl2 增重8Yg
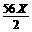 -8Y=9.6
(3)
-8Y=9.6
(3)
解①②③方程可得
x=0.4 Y=0.2 z=0.2
FeCl2%=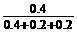 ×100%=50%
×100%=50%
巩固练习
(七)化学之“化”
1.风化--结晶水合物在室温和干燥的空气里失去部分或全部结晶水的过程.
注意:自然条件.
 区别:CuSO4·5H2O
CuSO4+5H2O
区别:CuSO4·5H2O
CuSO4+5H2O
2. 催化--能改变反应速度,本身一般参与反应但质量和化学性质不变.

|
|
4. 酸化:向某物质中加入稀酸使之呈酸性的过程.
思考:KMnO4溶液为何用H2SO4酸化而不用HCl?
提示:2MnO +16H+ +10Cl- = 2Mn2+ +5Cl2↑+8H2O
|
5.钝化:
|
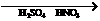 致密氧化膜→阻止内层金属与酸继续反应
致密氧化膜→阻止内层金属与酸继续反应
6.硬水软化--通过物理、化学方法除去硬水中较多的Ca2+、Mg2+的过程.
7.水化--烯、炔与H2O发生加成生成新的有机物.如乙烯 乙醇,
乙醇,
8.氢化(硬化)--液态油在一定条件下与H2发生加成反应生成固态脂肪的过程.
作用:植物油转变成硬化油后,性质稳定,不易变质,便于运输等.
9.皂化--油脂在碱性条件下发生水解反应的过程.
产物--高级脂肪酸钠+甘油
10.老化--橡胶、塑料等制品露置于空气中,因受空气氧化、日光照射而使之
变硬发脆的过程.
11.硫化--向橡胶中加硫,以改变其结构(双键变单键)来改善橡胶的性能,减
缓其老化速度的过程.
12.裂化--在一定条件下,分子量大、沸点高的烃断裂为分子量小、沸点低的
烃的过程.
石油裂化- 目的--提高汽油的质量和产量.
目的--提高汽油的质量和产量.
13.酯化--醇与酸生成酯和水的过程.
14.硝化(磺化)--苯环上的H被-NO2或-SO3H取代的过程.
…(八)无机化学反应的分类
 化合反应
化合反应
|
置换反应
复分解反应
|
 氧化-还原反应
氧化-还原反应
非氧化-还原反应
|
|
 离子反应
离子反应
非离子反应
|
 可逆反应
可逆反应
完全反应
|
放热反应
每一类基本反应中,要特别注意反应的定义、规律和重要实例.如:
1.化合反应
思考:化合反应是指单质间生成化合物的反应吗?
结论:不一定!化合反应即“多合一”的反应,根据反应物和生成物的种类,化合反应又可分为三种.
(1) 单质+单质→化合物
(2) 单质 + 化合物1 → 化合物
(3)化合物1 + 化合物2 → 化合物3
 如: 2Fe+3Cl2 = 2FeCl3
如: 2Fe+3Cl2 = 2FeCl3
|
2FeCl3+Fe = 3FeCl2
4Fe(OH) 2 + O2 + 2H2O = 4Fe(OH)3
常见错误:认为只有FeCl3才能用化合反应制得,而FeCl2、Fe(OH)3不能用化合反应制得。
2.分解反应:
可简述为“一分多”,产物有多种,未必要单质。如;
(1) 难溶性碱
 碱性氧化物 + 水
碱性氧化物 + 水
2)不稳定碱
(3)难溶性酸  酸酐 + 水
酸酐 + 水
(4)不稳定酸
(5)碳酸盐、硝酸盐、铵盐加热分解,Agx见光分解等
3.置换反应
思考:有单质参与或生成的反应一定是置换反应吗?
提示:反应物和生成物各两种且其中一种必定是单质的反应才称作置换反应.
注意:下列置换反应特别值得重视.
 ①2Na + 2H2O = 2NaOH + H2↑
①2Na + 2H2O = 2NaOH + H2↑
②3Fe +4H2O Fe3O4 + 4H2↑
③F2 + 2H2O = 4HF + O2
④Cl2 + H2S = S + 2HCl
|
|
 ⑥2C +SiO2 = Si + 2CO
⑥2C +SiO2 = Si + 2CO
|
 ⑦2Mg +CO2 = 2MgO + C
⑦2Mg +CO2 = 2MgO + C
|
 ⑧2Al +Fe2O3 = 2Fe + Al2O3
⑧2Al +Fe2O3 = 2Fe + Al2O3
 ⑨C +H2O = CO + H2
⑨C +H2O = CO + H2
 ⑩3Cl2 +2NH3 = N2 +
6HCl
⑩3Cl2 +2NH3 = N2 +
6HCl
 ⑾Si +4HF = SiF4+ 2H2
⑾Si +4HF = SiF4+ 2H2
4.复分解反应
(1)本质:通过两种化合物相互交换成份,使溶液中原一种或几种离子浓度显著降低.
 (2)离子浓度降低的形式: ①生成难溶性物质
(2)离子浓度降低的形式: ①生成难溶性物质
②生成气体或易挥发物
③生成弱电解质
(3)基本类型:
①酸 + 碱 → 盐 + 水(中和反应)
②酸 + 盐 → 新酸 + 新盐
③碱 + 盐 → 新碱 + 新盐
④盐 + 盐 → 两种新盐
⑤碱性氧化物+酸 → 盐+水
(3)盐与盐可能发生的反应有:
①复分解 ②双水解 ③氧化-还原 ④络合反应
现列表比较如下:
|
类 型 |
条 件 |
弱 产 物 |
实 例 |
|
氧化还原 反 应 |
阴、阳离子具有强氧化性,强还原性 |
弱氧化性产物 弱氧化性产物 |
2Fe3++S2-=2Fe2+ +S↓ |
|
双水解反应 |
阴、阳离子水解程度大且又无其它反应 |
弱 酸 弱 碱 |
2Al3++3S2-+6H2O
=2Al(OH)3+3H2S↑ |
|
复分解反应 |
能生成难溶性盐 |
两种新盐 |
AgNO3+NaCl=AgCl↓+NaNO3 |
 络合的反应 |
有中心体和强配体 |
稳定络合物 |
Fe3++6SCN- [Fe(SCN)6]3- |
 溶液
溶液 B+D
B+D 

 溶液
溶液
沉淀
溶液
溶液
溶液
沉淀
溶液


 A+D
B+C
A+D
B+C
 气体
沉淀 溶液
气体
气体
沉淀 溶液
气体  A+B
A+B