3、电子转移的表示方法
 (1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:
(1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
|

MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
注意两类特殊的化学反应。①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
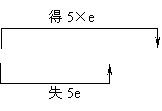 3Cl2+6KOH
3Cl2+6KOH KClO3+5KCl+3H2O
KClO3+5KCl+3H2O
 ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:

|
|
|

 KClO3+6HCl
KClO3+6HCl 3Cl2+ 6KCl↑ +3H2O Cl Cl
Cl
3Cl2+ 6KCl↑ +3H2O Cl Cl
Cl

|
|
|

 若理解为右图则错了。 Cl Cl
Cl
若理解为右图则错了。 Cl Cl
Cl

 氧化产物+还原产物
氧化产物+还原产物