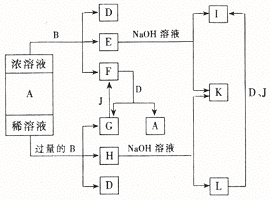
34、根据以下反应关系图,回答下列各问题:
 (1)A溶液中所含溶质是
、 (写化学式)。
(2)写出气体C和气体F反应的化学方程式:
(3)写出气体F与过量NaOH溶液反应的离子方程式:
34、答案:(1)Na2S
、Na2SO3
(2)SO2+2H2S==3S+2H2O
(3)SO2+2OH-==SO32-+H2O
35、为了进行I项实验,请从II项中选出一种试剂,从Ⅲ项中选出一种合适的实验操作方法,将标号填在后面的答案栏内。
(1)A溶液中所含溶质是
、 (写化学式)。
(2)写出气体C和气体F反应的化学方程式:
(3)写出气体F与过量NaOH溶液反应的离子方程式:
34、答案:(1)Na2S
、Na2SO3
(2)SO2+2H2S==3S+2H2O
(3)SO2+2OH-==SO32-+H2O
35、为了进行I项实验,请从II项中选出一种试剂,从Ⅲ项中选出一种合适的实验操作方法,将标号填在后面的答案栏内。
|
I实验 |
II试剂 |
Ⅲ操作方法 |
答案 |
||
|
I |
II |
Ⅲ |
|||
|
①除去苯中的苯酚 |
A、溴水 B、水 C、氢氧化钠溶液 D、氧化钙 E、碳酸钠溶液 |
a、蒸馏 b、过滤 c、洗气 d、分液 e、渗析 |
① |
|
|
|
②除去工业酒精中的水 |
② |
|
|
||
|
③除去乙酸乙酯中的乙酸 |
③ |
|
|
||
|
④除去溴乙烷中的乙醇 |
④ |
|
|
||
|
⑤除去甲烷中的乙烯 |
⑤ |
|
|
写出①和③中发生反应的化学方程式:
____________________________________________________________________________
___________________________________________________________________________。
32.制溴化亚铁可用以下装置:装置中a是一支瓷管,b是一只套住瓷管的电炉,c是两只耐高温的瓷舟(瓷舟内共盛有56 g的铁粉),d和e中的液体均为液溴。
实验开始时,先将瓷管加热至600℃-700℃,再用干燥的CO2气流将装置里的空气排净后继续缓慢地输进瓷管,最后溴从d中慢慢滴入已加热至100℃-120℃的e中,经过几个小时的反应,在瓷管的一端沉积着黄绿色鳞片状的
FeBr2 80 g。试回答下列问题:
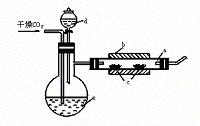
(1)如何检查用塞子(插有导管和仪器d)塞紧的e(未与瓷管连接)的气密性 。
(2)如果导入装置里的CO2没有干燥,就会发生副反应,该反应的化学方程式是 。
(3)瓷管两端的塞子,适宜于选用 作材料最佳,其理由是 。
A.橡皮 B.石棉 C.玻璃 D.软木
|
①是 ;②是 。
(5)根据反应方程式:2Fe+3Br2====2FeBr3
2FeBr3====2FeBr2+Br2↑求得这次实验中FeBr2的产率是 。
(6)为了防止污染空气,在装置最后应 。
32答案.(1)关闭活塞,在支管口与导管口各连接一段橡皮管并浸入水中,两手紧贴容器外壁(或酒精灯微热),若橡皮管口有气泡冒出,证明不漏气
|
(3)B 石棉耐高温,且溴不腐蚀石棉
(4)①使溴挥发逸出进入a管 ②将装置里的空气排尽,防止铁在高温下被氧化
(5)37%
(6)将尾气通入盛有NaOH溶液的烧杯中
31、已知四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂)如下表:
|
溶质 溶剂 |
AgNO3 |
Ba(NO3)2 |
AgCl |
BaCl2 |
|
水 |
170 |
9.3 |
1.5×10-4 |
33.3 |
|
液氨 |
86 |
97.2 |
0.8 |
0 |
(1)分别是1.0 mol· L-1的Ag+、Ba2+、NO-3和Cl-在水中发生反应的离子方程式是 。
(2)分别是0.50 mol·L-1的以上四种离子在液氨中发生反应的离子方程式是
。
(3)得出以上结论的依据是 。
(4)将以上四种离子按适当浓度混合于液氨之中,能否有AgCl沉淀析出?
答:________(“能”或“否”)。
31答案:(1)Ag++Cl-====AgCl↓ Ba2++2NO ====Ba(NO3)2↓
====Ba(NO3)2↓
(2)Ba2++2Cl-====BaCl2
(3)溶液中复分解反应发生的条件之一是有沉淀生成,而溶解度小者首先形成沉淀析出
(4)能
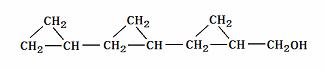 (4)
(4)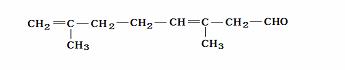 (4)柠檬醛分子有多种同分异构体,请写出属于醇类、分子结构中不含有甲基和不饱和碳原子的任意一种同分异构体的结构简式:_____________________________________.
(4)柠檬醛分子有多种同分异构体,请写出属于醇类、分子结构中不含有甲基和不饱和碳原子的任意一种同分异构体的结构简式:_____________________________________. C6H5OH +NaOH C6H5ONa
+ H2O
C6H5OH +NaOH C6H5ONa
+ H2O 
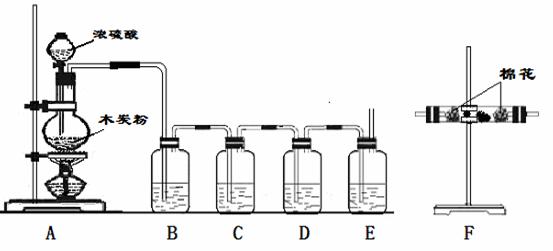 (1)写出木炭粉和浓硫酸反应的化学方程式:___________________。
(1)写出木炭粉和浓硫酸反应的化学方程式:___________________。 ___K2SO4+___Fe2(SO4)3+___NaOb↑+___H2O
___K2SO4+___Fe2(SO4)3+___NaOb↑+___H2O