0 34002 34010 34016 34020 34026 34028 34032 34038 34040 34046 34052 34056 34058 34062 34068 34070 34076 34080 34082 34086 34088 34092 34094 34096 34097 34098 34100 34101 34102 34104 34106 34110 34112 34116 34118 34122 34128 34130 34136 34140 34142 34146 34152 34158 34160 34166 34170 34172 34178 34182 34188 34196 447348
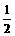 O2(g)==CO2(g);△H=-283.0kJ/mol,求C(s)+
O2(g)==CO2(g);△H=-283.0kJ/mol,求C(s)+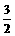 O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol-1
O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol-1 CuSO4 (s)+5H2O ;△H=+Q2KJ/mol,则Q1、Q2、(Q1、Q2均大于零)的关系为 ( )
CuSO4 (s)+5H2O ;△H=+Q2KJ/mol,则Q1、Q2、(Q1、Q2均大于零)的关系为 ( )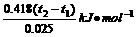
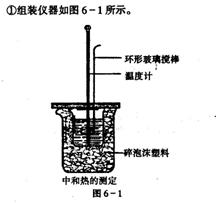 实验步骤:
实验步骤: