摘要:沉淀的颜色变化 (1)Fe2+:遇碱液生成沉淀.其颜色转变为:白→灰绿→红褐 (2)Ag+:遇碱液生成沉淀.其颜色转变为:白→黑
网址:http://m.1010jiajiao.com/timu3_id_340966[举报]
如图所示,将图1、图2两个装有不同物质的针筒用导管连接起来,将图2针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同).
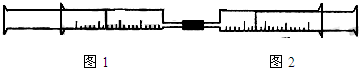
试回答下列问题:
(1)实验1中,沉淀最终变为
(2)实验2图1针筒内的现象是:
(3)实验3图1针筒内的现象是:
(4)实验4中,已知:3Cl2+2NH3=N2+6HCl.图1针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为
查看习题详情和答案>>

试回答下列问题:
| 实验序号 | 图1针筒内物质 | 图2针筒内物质 | 图1针筒的现象 |
| 1 | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 10mL1mol/LAlCl3溶液 | 40mL1mol/LNaOH溶液 | 先有白色沉淀,后沉淀溶解 先有白色沉淀,后沉淀溶解 |
| 3 | 10mL紫色石蕊试液 | 25mLCl2 | 先变红后褪色 先变红后褪色 |
| 4 | 15mLCl2 | 40mLNH3 | 黄绿色变为无色 黄绿色变为无色 |
红褐
红褐
色,写出沉淀变色的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(2)实验2图1针筒内的现象是:
先有白色沉淀,后沉淀溶解
先有白色沉淀,后沉淀溶解
,写出有关反应的离子方程式:Al3++3OH-=Al(OH)3↓
Al3++3OH-=Al(OH)3↓
、Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(3)实验3图1针筒内的现象是:
先变红后褪色
先变红后褪色
,反应后图2针筒内有少量的残留气体,正确的处理方法是将其通入NaOH
NaOH
溶液中.(4)实验4中,已知:3Cl2+2NH3=N2+6HCl.图1针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为
黄绿色变为无色
黄绿色变为无色
.某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应,反应式可能为2Na2O2+2SO2=2Na2SO3+O2,为此设计如下一套装置,来验证Na2O2和SO2的反应产物.如图安装仪器,检查装置气密性后添加药品并滴入适量浓硫酸,回答下列问题:

(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处两通管管壁发热,管内药品的颜色变化为
(2)在反应过程中如何用较简便的操作证明反应产生了O2?
(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因.
查看习题详情和答案>>

(1)点燃①处酒精灯,不久,观察到①处产生大量气体;③处两通管管壁发热,管内药品的颜色变化为
淡黄
淡黄
色逐渐变为白
白
色.(2)在反应过程中如何用较简便的操作证明反应产生了O2?
打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2
打开④处U型管a处橡皮塞,插入带火星的木条,如果复燃,说明产生了O2
.(3)⑥处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?
⑤处品红溶液不褪色,说明氧气中不混有二氧化硫
⑤处品红溶液不褪色,说明氧气中不混有二氧化硫
.(4)待反应结束后,取两通管内少量固体,装入试管中,加水溶解时未产生气体,如何证明产物中有Na2SO3?
加入盐酸,若有刺激性气味的气体逸出,则证明产物中含有Na2SO3
加入盐酸,若有刺激性气味的气体逸出,则证明产物中含有Na2SO3
.(5)待反应结束后,取两通管内少量固体,装入试管中,加入足量盐酸溶液,再加入氯化钡溶液,有白色沉淀生成,试分析产生沉淀的原因.
由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4和BaCl2反应产生难溶于盐酸的BaSO4
由于过氧化钠有氧化性,反应过程中有部分亚硫酸钠被氧化为Na2SO4和BaCl2反应产生难溶于盐酸的BaSO4
.已知A为常见的金属单质,根据图所示的关系:
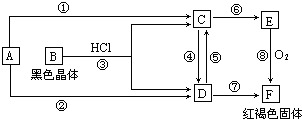
(1)确定A、B的化学式,A为
(2)C和D可相互转化,描述C→D溶液的颜色变化:
④的离子方程式:
⑤的离子方程式:
(3)由E→F的实验现象为:
查看习题详情和答案>>

(1)确定A、B的化学式,A为
Fe
Fe
,B为Fe3O4
Fe3O4
.(2)C和D可相互转化,描述C→D溶液的颜色变化:
溶液由浅绿色到黄色
溶液由浅绿色到黄色
.④的离子方程式:
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.⑤的离子方程式:
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(3)由E→F的实验现象为:
沉淀由白色很快变为灰绿色,最后变为红褐色
沉淀由白色很快变为灰绿色,最后变为红褐色
.
某同学创新设计制备氢氧化亚铁的实验方案:
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
(二)实验步骤及现象
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入 .向硫酸亚铁溶液中慢慢加入无水乙醇时,产生气泡的原因是 .某同学制备无水乙醇的方法是向无水乙醇(含乙醇的质量分数为99.5%以上)中加入一定量的氯化钙,然后蒸馏得到无水乙醇,你认为此方法能否得到无水乙醇? (填“能”或“否”).
(2)预测上述白色固体的成分可能是 ,保持白色的主要原因是 .
(3)写出生成白色沉淀的化学方程式: .
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:
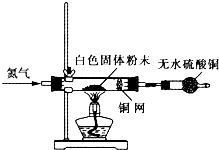
先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是 ,铜网的作用是 .
(5)证明白色固体粉末中含有+2价铁的实验现象为 :写出符合要求的方程式: .
属于分解反应的化学方程式: ;属于氧化还原反应的离子方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是 .
查看习题详情和答案>>
(一)查阅资料
资料1:乙醇不与氢氧化钠或硫酸亚铁反应;乙醇与水互溶,氢氧化钠能溶于乙醇;硫酸亚铁在乙醇中的溶解度比在水中的溶解度小.氮气不能与铜反应.
资料2:几种含铁物质的颜色
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
①取少量的新制硫酸亚铁晶体于大试管中,向其中加入5mL热蒸馏水,使之充分溶解,然后向其中慢慢加入10mL无水乙醇,这时会发现溶液中有小气泡逸出,静置,直到无小气泡冒出为止.
②另取一支试管,向其中加入半药匙固体氢氧化钠,然后向其中加入5mL无水乙醇,充分溶解后静置.
③用长胶头滴管吸取新配制的氢氧化钠的乙醇溶液,伸入硫酸亚铁溶液中,慢慢地挤压橡胶头,连续吸取几次,使之充分反应,静置片刻,这时在试管底会有大量的白色凝乳状溶胶沉降.
④小心地倒去上层溶液,再向试管中加入3mL无水乙醇洗涤,连续洗涤两三次,这时白色的凝乳状溶胶会变成白色固体,然后倒在滤纸上使乙醇充分挥发,便得到白色固体粉末.
(1)为避免硫酸亚铁在溶于水的过程中被氧化,通常可以向溶液中加入
(2)预测上述白色固体的成分可能是
(3)写出生成白色沉淀的化学方程式:
(三)探究产物成分
Ⅰ利用如图所示装置检验白色粉末的性质:

先通入氮气排尽装置内的空气后,继续通入氮气,然后加热硬质试管,观察到无水硫酸铜逐渐变成蓝色;硬质试管里的白色固体粉末逐渐变成黑色;铜网没有明显的颜色变化.当白色固体粉末全部变成黑色粉末时,停止加热,继续通入氮气至硬质试管冷却.
Ⅱ.待冷却后,取适量黑色粉末溶于少量的稀盐酸中,黑色粉末溶解,溶液呈浅绿色,不产生气泡.
Ⅲ.取Ⅱ中的溶液于试管中,滴加酸性高锰酸钾溶液,溶液的紫色褪去.
(4)实验1中,氮气的作用是
(5)证明白色固体粉末中含有+2价铁的实验现象为
属于分解反应的化学方程式:
(6)某同学在上述实验的基础上,增加了一个实验确认白色固体中不含+3价铁,设计的实验可能是
(10分)为了测定实验室长期存放的Na2SO3固体的纯度,某化学活动小组设计了多种实验方案。准确称取W g固体样品,配成250mL溶液。分成三组进行实验:
甲组:量取25.00mL上述溶液,加入足量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1g
乙组:量取25.00mL上述溶液,加入足量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2g
丙组:量取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定。消耗KMnO4溶液b mL。
(1) 配制250mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管和 。
(2) 在丙组实验中滴定时是否需要选择指示剂? (填“需要”或“不需要”)。滴定终点的颜色变化是 。
(3) 用丙组的实验数据,计算Na2SO3的纯度 。
(4) 实验中发现,乙组同学测定的Na2SO3纯度比甲组和丙组同学的结果都要低。试分析产生上述现象的原因 。
查看习题详情和答案>>