2、金属的腐蚀与防护
(1) 化学腐蚀与电化腐蚀
|
|
化学腐蚀 |
电化腐蚀 |
|
定义 |
金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程。 |
不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程。 |
|
本质 |
无电流 |
有弱电流 |
|
现象 |
金属被腐蚀 |
较活泼金属被腐蚀 |
|
实例 |
金属与Cl2、O2等物质直接反应 |
钢铁在潮湿的空气中被腐蚀 |
(2) 金属腐蚀的快慢的判断方法
不纯的金属或合金,在潮湿的空气中形成原电池发生电化腐蚀,活泼金属因被腐蚀而损耗,金属腐蚀的快慢与下列两种因素有关:
a、与构成原电池两极的材料有关。两极材料的活动性差别越大、电动势越大、氧化还原反应的速率越快,活泼金属被腐蚀的速率越快。
b、与金属所接触的电解质强弱有关。活泼金属在电解质溶液中的腐蚀快于非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般说来可用来下列原则判断:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀
同种金属腐蚀:强电解质>弱电解质>非电解质
☆ 巧思巧解:
1、 原电池、电解池比较
|
|
原电池 |
电解池 |
||||||||||
|
定义 |
 将化学能转变成电能的装置 将化学能转变成电能的装置 |
将电能转变成化学能的装置 |
||||||||||
|
装置 举例 |
|
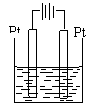
|
||||||||||
|
形成 条件 |
①活动性不同的两个电极; ②同时插入同一电解质溶液; ③用导线相互连接或直接接触组成闭合回路 |
①两电极接直流电源 ②两电极同时插入同一电解质溶液 ③用导线相互连接组成配合回路 |
||||||||||
|
电极 名称 及判断 |
负极:电子流出的极或较活泼的金属电极或发生氧化反应的电极。 正极;电子流入的极或较不活泼的金属电极或发生还原反应的电极。 |
阴极:与电源负极相连的极 阳极:与电源正极相连的极  电极的种类 惰性电极:Pt、Au、石墨等 电极的种类 惰性电极:Pt、Au、石墨等(依材料分) 活性电极:除Pt、Au、石墨外 |
||||||||||
|
反应原理 |
   Zn-2e-=Zn2+ 2H++2e-=H2↑ |
  
 
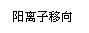  
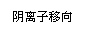
|
||||||||||
|
电极反应 |
负极:电极本身失电子,发生氧化反应。 正极:电极本身不反应,溶液中的某些离子在正极上获得电子,发生还原反应。 阳离子放电顺(氧化性强弱顺序): Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+ |
阳极:若为惰性电极,则电极本身不反应,溶液中的阴离子失去电子,发生氧化反应 阴离子放电顺序(还原性强弱顺序):S2―> I―>Br―>Cl―>OH―>含氧酸根 若为活性电极:则电极本身失去电子,发生 氧化反应。 阴极:电极本身不反应,溶液中阳离子在阴 极上获得电子,发生还原反应。 |
||||||||||
|
电子流向 |
  负极
正极 负极
正极 |
电源负极→沿导线→阴极→电解溶液中离子的移动→阳极→沿导线→电源正极 |
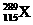 。下列有关叙述正确的是
。下列有关叙述正确的是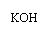
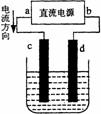 [例2]右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
[例2]右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
 总反应:2NaCl + 2 H2O
总反应:2NaCl + 2 H2O
 2NaOH
+H2↑+Cl2↑
2NaOH
+H2↑+Cl2↑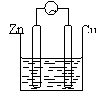
 RNHCH2R’
RNHCH2R’ 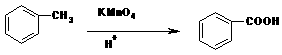
 (苯胺,弱碱性,易被氧化)
(苯胺,弱碱性,易被氧化)
