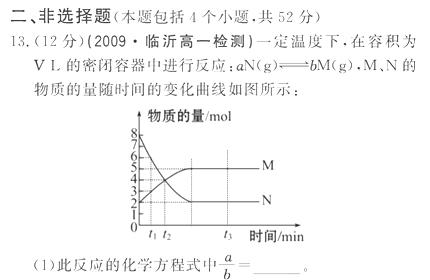
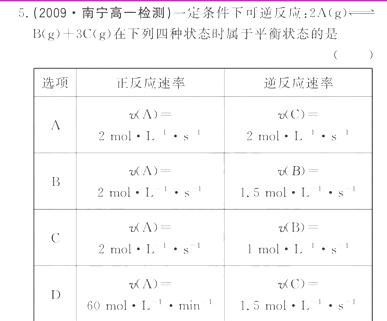
0 23401 23409 23415 23419 23425 23427 23431 23437 23439 23445 23451 23455 23457 23461 23467 23469 23475 23479 23481 23485 23487 23491 23493 23495 23496 23497 23499 23500 23501 23503 23505 23509 23511 23515 23517 23521 23527 23529 23535 23539 23541 23545 23551 23557 23559 23565 23569 23571 23577 23581 23587 23595 447348
 (14分)(2009·天津高考,改造题)
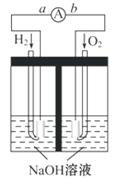
(14分)(2009·天津高考,改造题)  (3)电极表面镀铂粉的原因为_________。
(3)电极表面镀铂粉的原因为_________。 
 、O2分子数,加快电极反应速率 (4)Li H2O
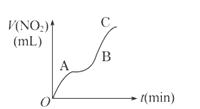
、O2分子数,加快电极反应速率 (4)Li H2O 响均可排除。温度的影响是重点和关键。这就要看我们在做实验的时候,是否认真、细心观察所发生的一切现象,并有所感受。若从温度的影响来看肯定是升高了反应体系的温度,且温度升高的影响大于浓度减小的影响,但并没有加热,所以只能是反应本身所产生的热量所致。t2→t3主要是浓度减小占主要影响因素了。
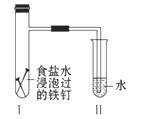
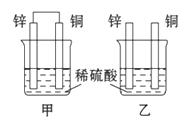
响均可排除。温度的影响是重点和关键。这就要看我们在做实验的时候,是否认真、细心观察所发生的一切现象,并有所感受。若从温度的影响来看肯定是升高了反应体系的温度,且温度升高的影响大于浓度减小的影响,但并没有加热,所以只能是反应本身所产生的热量所致。t2→t3主要是浓度减小占主要影响因素了。  质溶液:盐酸;实验四:正极:铜、负极:锌、电解质溶液:盐酸。
质溶液:盐酸;实验四:正极:铜、负极:锌、电解质溶液:盐酸。