0 23384 23392 23398 23402 23408 23410 23414 23420 23422 23428 23434 23438 23440 23444 23450 23452 23458 23462 23464 23468 23470 23474 23476 23478 23479 23480 23482 23483 23484 23486 23488 23492 23494 23498 23500 23504 23510 23512 23518 23522 23524 23528 23534 23540 23542 23548 23552 23554 23560 23564 23570 23578 447348
 接加热法和电解法冶炼得到
接加热法和电解法冶炼得到 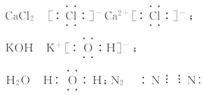 [解析]选B。这四种物质的电子式分别为:
[解析]选B。这四种物质的电子式分别为: 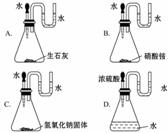 如图,加入水或酸后,各装置U形管中的液柱左边高于右边的是( )
如图,加入水或酸后,各装置U形管中的液柱左边高于右边的是( ) 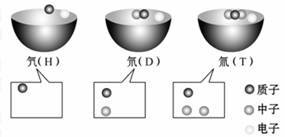 科学家们发现有3种氢原子,氕、氘、氚这3种氢原子中质子、中子
科学家们发现有3种氢原子,氕、氘、氚这3种氢原子中质子、中子 和电子的数量关系如图所示:
和电子的数量关系如图所示: 
 :
______________________________________。
:
______________________________________。
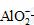 +2H2O
+2H2O

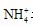 水解, 故要使其浓度与Cl-
相等, 则要补充NH3·H2O。
水解, 故要使其浓度与Cl-
相等, 则要补充NH3·H2O。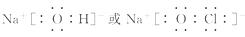
 4Al+3O2↑
4Al+3O2↑ 反应H2+I2 ==== 2HI, 形成2 mol HI放出2×299 kJ的热量, 所以生成1 mol HI时放出热量为
反应H2+I2 ==== 2HI, 形成2 mol HI放出2×299 kJ的热量, 所以生成1 mol HI时放出热量为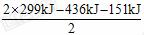 =5.5
kJ。
=5.5
kJ。