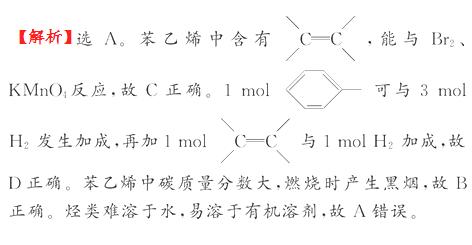
0 23400 23408 23414 23418 23424 23426 23430 23436 23438 23444 23450 23454 23456 23460 23466 23468 23474 23478 23480 23484 23486 23490 23492 23494 23495 23496 23498 23499 23500 23502 23504 23508 23510 23514 23516 23520 23526 23528 23534 23538 23540 23544 23550 23556 23558 23564 23568 23570 23576 23580 23586 23594 447348
 CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6
g。(已知两个羟基连在同一个碳上不稳定会自动失去一个水)
CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6
g。(已知两个羟基连在同一个碳上不稳定会自动失去一个水) 

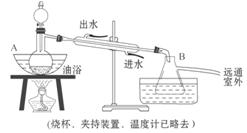

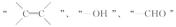 请你写出下列官能团
请你写出下列官能团  ____
____ 反应放出O2
反应放出O2 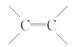 D、F正确,该有机物不能发生水解反应,正确的选项为B、D、F。
D、F正确,该有机物不能发生水解反应,正确的选项为B、D、F。  _与烧碱通过皂化反应获得。
_与烧碱通过皂化反应获得。  它们组成中n值不同,所以不互为同分异构体。其中淀粉最终水解生成葡萄糖。
它们组成中n值不同,所以不互为同分异构体。其中淀粉最终水解生成葡萄糖。  6CO2+6H2O
6CO2+6H2O







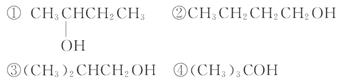
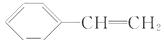 它一般不可能具有的性质是( )
它一般不可能具有的性质是( )