8. 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中, 破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ, 破坏
1 mol 氯气中的化学键消耗的能量为Q2 kJ, 形成1 mol 氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中, 正确的是( )
A. Q1+Q2>Q3 B. Q1+Q2>2Q3
|
[解析]选D。氢气在氯气中燃烧: Cl2+H2 ====2HCl, 该反应放出热量, 即反应中形成化学键所释放的能量大于断裂化学键所吸收的能量。在反应中, 要破坏1 mol H-H键、1 mol Cl-Cl键, 形成2 mol H-Cl键, 所以2Q3-(Q1+Q2)>0, 即Q1+Q2<2Q3。
 2CO2+3H2O。
2CO2+3H2O。 2HI(g), 下列情况一定能说明反应已达到平衡状态的是( )
2HI(g), 下列情况一定能说明反应已达到平衡状态的是( ) 压强不再随时间而改变时
压强不再随时间而改变时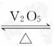 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )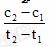
 确。
确。 径之比最大的是(
)
径之比最大的是(
)