0 23484 23492 23498 23502 23508 23510 23514 23520 23522 23528 23534 23538 23540 23544 23550 23552 23558 23562 23564 23568 23570 23574 23576 23578 23579 23580 23582 23583 23584 23586 23588 23592 23594 23598 23600 23604 23610 23612 23618 23622 23624 23628 23634 23640 23642 23648 23652 23654 23660 23664 23670 23678 447348
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2  )利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为: 
 ,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。
,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。 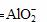 +2H2O b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
+2H2O b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色 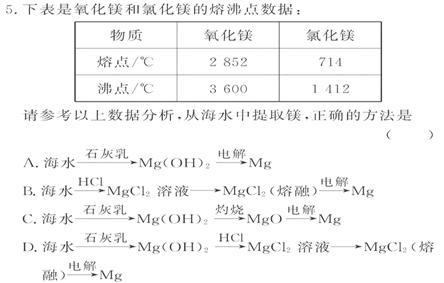
 海水中Mg2+ 浓度比较低,首先要完成对Mg2+
的富集(用石灰乳使Mg2+ 变为沉淀)。MgO的熔沸点远高于MgCl2,故电解MgO要比电解MgCl2更耗能。
海水中Mg2+ 浓度比较低,首先要完成对Mg2+
的富集(用石灰乳使Mg2+ 变为沉淀)。MgO的熔沸点远高于MgCl2,故电解MgO要比电解MgCl2更耗能。 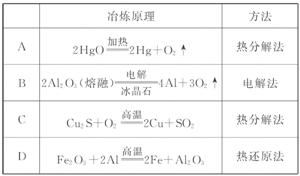
 阳光蒸发浓缩后的海水中,加入沉淀剂(合理均可)
阳光蒸发浓缩后的海水中,加入沉淀剂(合理均可)  Mg+Cl2↑
Mg+Cl2↑
 _________
;
_________
; 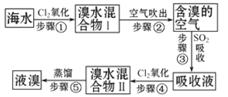
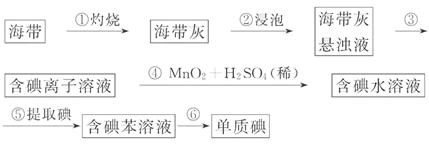
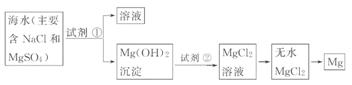
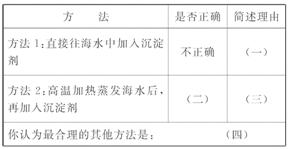 (1)关于加入试剂①作沉淀剂,同学们提出了不同方法。请你参与他们的讨
(1)关于加入试剂①作沉淀剂,同学们提出了不同方法。请你参与他们的讨