摘要:由前述可知:△H与始态终态有关而与途径无关.所以盖斯定律为:不管化学反应是一步完成或分几步完成.其反应热是相同的.如: 例4:在298K.100kPa时.已知:2 ,⊿ ,⊿ ,⊿ 则⊿与⊿和⊿间的关系正确的是( ) A .⊿=⊿+2⊿ B ⊿=⊿+⊿ C. ⊿=⊿-2⊿ D. ⊿=⊿- ⊿ 解 析: 由盖斯定律知:A正确
网址:http://m.1010jiajiao.com/timu3_id_83254[举报]
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“△H”表示,△H=H(终态)-H(始态).
(1)化学反应中的△H是以
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的△H为
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ?mol-1,△H(H2)=436kJ?mol-1,
△H(Cl2)=247kJ?mol-1.则△H(HCl)=
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的△H便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ?mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ?mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ?mol-1
请写出CO还原FeO的热化学方程式:
查看习题详情和答案>>
(1)化学反应中的△H是以
热能
热能
的形式体现的.对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的△H为
小于
小于
0(填“大于”.“小于”),该反应是放热
放热
(填“放热”或“吸热”)反应;(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ?mol-1,△H(H2)=436kJ?mol-1,
△H(Cl2)=247kJ?mol-1.则△H(HCl)=
434kJ?mol-1
434kJ?mol-1
.(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的△H便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ?mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ?mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ?mol-1
请写出CO还原FeO的热化学方程式:
FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ?mol-1
FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ?mol-1
.如图所示与对应的叙述相符的是( )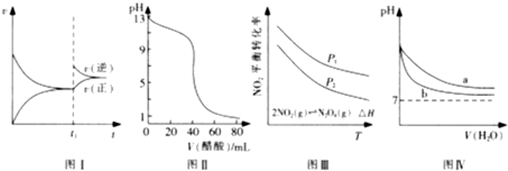

| A、图I可表示N2+3H2?2NH3的速率时间图象,t1时刻改变的条件是升高温度 | B、图Ⅱ可表示用0.1 000 mol/L醋酸滴定40.00 mL0.1000 mol/LNaOH溶液得到的滴定曲线 | C、图Ⅲ可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2 | D、图Ⅳ可表示pH相同的NaOH溶液与氨水稀释过程的pH变化.其中曲线a对应氨水 |
下列关于甲、乙、丙、丁四个图像的说法中,不正确的是

A.甲是向KAl(S04)2溶液滴加Ba(0H)2时,沉淀质量与Ba(OH)2物质的量的关系图
B.乙是向溴水通入S02气体时,pH与S02物质的量的关系图
C.丙是向c(H+)相同的醋酸和盐酸滴入水时,c(H+)与水体积的关系图
D.由丁可知,A与B在有催化剂存在的热化学方程式为: 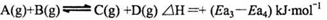
查看习题详情和答案>>
下列图示与对应的叙述相符的是

A.图I可表示N2+3H2  2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度
B.图Ⅱ可表示用0.1 000 mol/L醋酸滴定40.00 mL0.1000 mol/LNaOH溶液得到的滴定曲线
C.图Ⅲ可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2
D.图Ⅳ可表示pH相同的NaOH溶液与氨水稀释过程的pH变化.其中曲线a对应氨水
查看习题详情和答案>>
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以_______ 的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为____0(填“大于”.“小于”),该反应是 _____(填“放热”或“吸热”)反应。
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。
已知:298K时,
H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ/mol ΔH(H2)= 436 kJ/mol, ΔH(Cl2)= 247 kJ/mol。 则ΔH(HCl)= ________________。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH = -25 kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH = -47 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH = +19 kJ/mol
请写出CO还原FeO的热化学方程式_______________________。
查看习题详情和答案>>
(1)化学反应中的ΔH是以_______ 的形式体现的。对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为____0(填“大于”.“小于”),该反应是 _____(填“放热”或“吸热”)反应。
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。
已知:298K时,
H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ/mol ΔH(H2)= 436 kJ/mol, ΔH(Cl2)= 247 kJ/mol。 则ΔH(HCl)= ________________。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH = -25 kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH = -47 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH = +19 kJ/mol
请写出CO还原FeO的热化学方程式_______________________。