摘要: A.B.C.D为原子序数小于18的四种元素: ①A的原子的电子层数等于最外层电子数, ②A与B处于同一周期.B与D可形成离子化合物D2B.该化合物的水溶液显碱性, ③C的离子核内质子数与核外电子数之和为18, ④A.C.D三种元素的离子具有相同的电子层排布. 推断A-D各为何种元素.并填空: (1)A ,B ,C ,D . (2)四种元素离子半径的大小顺序为 . (3)用离子方程式表示D2B水溶液呈碱性的原因 . 解析:A.B.C.D均为短周期元素.由①可知A的族序数等于周期数.可能为H.Be.Al.由②可知,短周期可形成D2B离子化合物有Li2O.Na2O.Na2S.它们的水溶液为碱性.由③可知若C为阴离子Cn-.则设核电荷数c.有2c+n=18(n取偶数).n=2时.c=8.为O.O2-离子在熔融的金属氧化物中存在.n=4时.c=7为N.无N4+离子.舍去.n不可能大于5.若C为阳离子Cn+.由2c-n=18(n取偶数).n=2时.c=10.为Ne.舍去,n=4时.c=11为Na.无Na4+.舍去,n=6时.c=12.为Mg.无Mg6+舍去.故C为O元素.由④知A.C.D必为相邻周期元素.所以C为O.则A为Al.D为Na. 答案:r(S2-)>r(O2-)>r(Na+)>r(Al3+) (3)S2-+H2OHS-+OH- HS-+H2OH2S+OH-
网址:http://m.1010jiajiao.com/timu3_id_79006[举报]
A、B、C、D为原子序数小于18的四种元素:
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A
(2)四种元素离子半径的大小顺序为
(3)用离子方程式表示D2B水溶液呈碱性的原因
查看习题详情和答案>>
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A
Al
Al
;BS
S
;CO
O
;DNa
Na
.(2)四种元素离子半径的大小顺序为
r(S2-)>r(O2-)>r(Na+)>r(Al3+)
r(S2-)>r(O2-)>r(Na+)>r(Al3+)
.(3)用离子方程式表示D2B水溶液呈碱性的原因
S2-+H2O
HS-+OH-、HS-+H2O
H2S+OH-.
| 水解 |
| 水解 |
S2-+H2O
HS-+OH-、HS-+H2O
H2S+OH-.
.| 水解 |
| 水解 |
A、B、C、D为原子序数小于18的四种元素:
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A______;B______;C______;D______.
(2)四种元素离子半径的大小顺序为______.
(3)用离子方程式表示D2B水溶液呈碱性的原因______.
查看习题详情和答案>>
①A的原子的电子层数等于最外层电子数;
②A与B处于同一周期,B与D可形成离子化合物D2B,该化合物的水溶液显碱性;
③C的离子核内质子数与核外电子数之和为18;
④A、C、D三种元素的离子具有相同的电子层排布.
推断A~D各为何种元素,并填空:
(1)A______;B______;C______;D______.
(2)四种元素离子半径的大小顺序为______.
(3)用离子方程式表示D2B水溶液呈碱性的原因______.
A、B、C、D为原子序数小于18的四种元素:A原子的电子层数等于最外层电子数;A与B处于同一周期,B与D 可形成离子化合物D2B,该化合物在水溶液中水解显碱性;C的离子核内质子数与核外电子数之和为18;A、C、D 三种元素的离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)写出元素B的元素符号_________,元素B的氢化物的空间构型为__________。
(2)写出D原子形成简单离子的电子排布式________________。
(3)四种元素离子半径的大小顺序为__________,第一电离能最小的是__________。
(4)C的双原子单质分子中含有____个σ键和______个π键,元素C的三原子氢化物中,中心原子C的杂化方式为____________。
(5)元素A和C形成的化合物熔点高,硬度大,工业上常采用电解熔融该化合物的方法来制备单质A。由此 可推断A、C形成的化合物为__________晶体。
查看习题详情和答案>>
(1)写出元素B的元素符号_________,元素B的氢化物的空间构型为__________。
(2)写出D原子形成简单离子的电子排布式________________。
(3)四种元素离子半径的大小顺序为__________,第一电离能最小的是__________。
(4)C的双原子单质分子中含有____个σ键和______个π键,元素C的三原子氢化物中,中心原子C的杂化方式为____________。
(5)元素A和C形成的化合物熔点高,硬度大,工业上常采用电解熔融该化合物的方法来制备单质A。由此 可推断A、C形成的化合物为__________晶体。
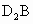 ,该化合物的水溶液呈碱性,C的离子核内质子数与核外电子数之和为18,A、C、D三元素的简单离子具有相同的电子层排布,填空:
,该化合物的水溶液呈碱性,C的离子核内质子数与核外电子数之和为18,A、C、D三元素的简单离子具有相同的电子层排布,填空: