23、(9分)元素周期表是学习化学的重要工具,它饮食许多信息和规律。下表所列是五种短周期的原子半径及主要化合价:
|
元素代号 |
A |
B |
C |
D |
E |
|
原子半径/m |
0.16 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6,-2 |
+2 |
-2 |
(1)用元素代号标出它们的周期表中对应位置
(2)在上面的元素周期表中通常寻找催化剂材料的区域,用粗线标出。
(3)五种元素中非金属性最强的是 (填元素符号),C、E形成化合物为 (填化学式)
(4)证明B元素与A元素在性质上有明显不同的离子方程式为
21、将0.2mol/LNaA溶液和0.1mol/L盐酸等体积混全后,溶液pH>7,则以下关系式错误的是 ( )
|
B.c(A-)>c(HA)
C.c(Na+)+c(H+)=c(A-)+c(C1-)+c(OH-)
D.c(Na+)=c(A-)+c(HA)

 (6分)在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
(6分)在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据: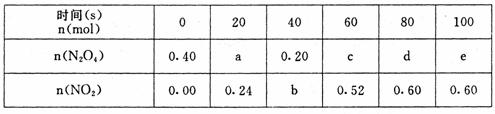
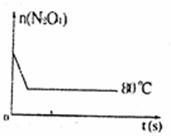 A.增大N2O4的起始浓度 B.向混合气体中通入NO2
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
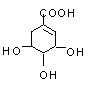 莽草酸是制取抗甲型H1N1流感药物“达菲”的中间活性物质,其结构简式如图所示。它不可能存在下列类别的同分异构体
( )
莽草酸是制取抗甲型H1N1流感药物“达菲”的中间活性物质,其结构简式如图所示。它不可能存在下列类别的同分异构体
( )
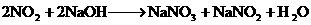 ;
;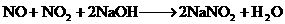 。将224 mL(SPT)NO和
。将224 mL(SPT)NO和 的混合气体溶于20 mL NaOH溶液中,恰好完全反应并无气体逸出,则NaOH溶液的物质的量浓度为 ( )
的混合气体溶于20 mL NaOH溶液中,恰好完全反应并无气体逸出,则NaOH溶液的物质的量浓度为 ( )