9.(1)N 第三周期IA族(每空2分) 教育博客 (2)Na [∶O∶O∶]
[∶O∶O∶] Na
Na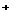 (2分)
(2分)
(3)3NaN3=Na3N+4N2↑(3分)
(4)C2H2(g)+ O2(g)=2CO2(g) +H2O(
O2(g)=2CO2(g) +H2O(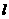 );△H=-313.5 kJ/mol(3分)
);△H=-313.5 kJ/mol(3分)
(5)Na2CO3或Na2CO3和NaOH(3分)
解析:B的最外层电子数是次外层电子数的2倍,应为碳,由A、B可组成B2A2的化合物中含有非极性键可推知B2A2是C2H2;A、E同主族,且A、B、C、D、E原子序数依次增大,可推知E是钠,A、D、E组成化合物A2D2,E2D2可推知A2D2是H2O2,E2D2是Na2O2,故D是氧,则C为氮,故EC3是NaN3。2 mol NaHCO3分解得到1 mol CO2和1 mol水蒸气,由于CO2和H2O都可与Na2O2反应生成O2,故150℃时所得的教育博客2种气体中一定含有O2,又因为CO2和H2O与Na2O2反应时,可看作是CO2先反应,故另一种气体必为水蒸气。此时,应有两种可能,一是Na2O2恰好与CO2反应,二是水蒸气只有部分与Na2O2反应,故反应后固体是Na2CO3或Na2CO3和NaOH,一定无Na2O2。
|
10:(1)O=C=O (2)MOH+SO2=MHSO3(3)Fe2O3+3CO 2Fe+3CO2 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
2Fe+3CO2 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
(4)Al3++4OH-=AlO2-+2H2O Al3++3AlO2-+6H2O=4Al(OH)3↓(每空2分) 教育博客
解析:本题框图特点是,A与E反应,相对量不同产物不同;且产物之间可以相互转化,符合条件的A、B、D必须具有“三角”转化关系。 (1)依题意,B为极性键形成的非极性分子,中学常见的物质有二氧化碳、二硫化碳、四氯化碳、甲烷等,而A、E为单质,常见的物质中只有碳和氧气,氧气过量生成二氧化碳,氧气不足生成一氧化碳。二氧化碳是由极性键形成的非极性分子。所以,A为碳,B为二氧化碳,D为一氧化碳,E为氧气。教育博客
(2)依题意,E为SO2,用强碱MOH作为化学式写化学方程式,M可能是钠,钾,铷,铯。
(3)依题意,B中含有Fe2+,滴加盐酸,Fe2+转化成Fe3+,说明溶液中含有NO3-,即A为硝酸,E为铁,B为硝酸亚铁,D为硝酸铁。硝酸铁中含少量硝酸亚铁,可以滴加稀硝酸除去,化学方程式为3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O,除杂质不能引入新杂质。教育博客
(4)依题意,A为氯化铝,B为偏铝酸盐,D为氢氧化铝。教育博客
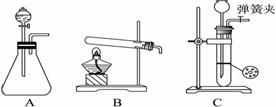
10 (1)BCA(6分)教育博客
(2)①2Na+2CO2 CO+Na2CO3②4Na+3CO2
CO+Na2CO3②4Na+3CO2 2Na2CO3+C(6分)教育博客
2Na2CO3+C(6分)教育博客
(3)将残留物溶于适量水,若有黑色不溶物则证明残留物中有C,在溶液中加足量BaCl2溶液,然后过滤,在滤液中滴加几滴酚酞,若溶液变红,则证明残留物中含有Na2O。(4分)
解析: (1) 碳酸氢钠分解制二氧化碳的装置是使用”固体+固体”加热装置,即选B;
块状石灰石与稀盐酸反应,不能选A ,教育博客A装置不适用于块状固体与液体反应,即选C;粉末状碳酸钠固体与稀硫酸反应可选A。(2)①装置6教育博客中有黑色沉淀,依题中信息知产生了CO,残留物与HCl作用产生CO2,则残留物中含Na2CO3。②残留物与HCl作用产生CO2,证明残留物中含Na2CO3,而又无CO产生,根据氧化还原反应规律知,钠被氧化,则必有元素被还原,联系残留固体中有两种物质故知有C生成。教育博客 (3)根据碳不溶于水,可证明之,根据Na2O+H2O 2NaOH溶液显碱性可证明Na2O存在,但Na2CO3溶液也显碱性,对实验有干扰,故先将
2NaOH溶液显碱性可证明Na2O存在,但Na2CO3溶液也显碱性,对实验有干扰,故先将 用Ba2+沉淀。教育博客
用Ba2+沉淀。教育博客
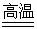 Na2SiO3+ CO2↑
Na2SiO3+ CO2↑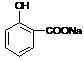 (3分)
(3分)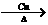 2CH3COCH3+H2O (3分)
2CH3COCH3+H2O (3分)
 +H2O(3分)
+H2O(3分)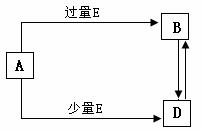 (15分)已知A、B、D、E均为中学化学常见单质及化合物,它们之间的转化关系如图所示(部分产物略去)。
(15分)已知A、B、D、E均为中学化学常见单质及化合物,它们之间的转化关系如图所示(部分产物略去)。