29.在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:用大小、外形均相同的铝片分别和H+浓度相同的稀盐酸、稀硫酸反应,铝片与稀盐酸反应放出气泡的速度明显快于与稀硫酸反应放出气泡的速度。是什么原因导致了反应现象的差异呢? 他从微观角度分析得出,H+浓度相同的盐酸、硫酸中,只是所含 不同。
他进行了如下实验探究:
|
组别 |
相同的铝片 |
H+浓度相同的酸 |
反应片刻后添加某种试剂(少量) |
添加试剂后的反应现象 |
结论 |
|
1 |
1g铝片 |
5mL盐酸 |
Na2SO4 |
无明显变化 |
和 离子对反应无影响 |
|
2 |
1g铝片 |
5mL硫酸 |
NaCl |
明显加快 |
离子对反应有促进作用 |
针对上述探究过程回答下列问题:
(1)请你将表格中的空格补充完整;(2)你认为原因可能是
(3)若将第2组实验中添加的试剂NaCl改为HCl气体,能否完成探究任务?请说明原因
28、(1)I.图表法、图象法是常用的科学研究方法。
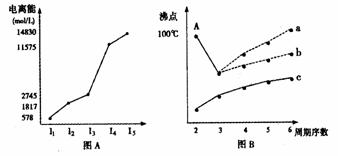 电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子。短周期某主族元素M逐个失去电子的电离能情况如图(A)所示。则M元素位于周期表的第 族
电离能可以定量的比较气态原子失去电子的难易,电离能越大,原子越难失去电子。短周期某主族元素M逐个失去电子的电离能情况如图(A)所示。则M元素位于周期表的第 族
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
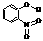 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
 |
1.7 |
114 |
295 |
(3)下列物质的熔点高低顺序,正确的是___________
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr
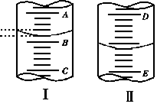 如右图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。
如右图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。 H++F-
H++F-