摘要:元素周期表是学习化学的重要工具.它饮食许多信息和规律.下表所列是五种短周期的原子半径及主要化合价: 元素代号 A B C D E 原子半径/m 0.16 0.143 0.102 0.089 0.074 主要化合价 +2 +3 +6,-2 +2 -2 (1)用元素代号标出它们的周期表中对应位置 (2)在上面的元素周期表中通常寻找催化剂材料的区域.用粗线标出. (3)五种元素中非金属性最强的是 .C.E形成化合物为 (4)证明B元素与A元素在性质上有明显不同的离子方程式为
网址:http://m.1010jiajiao.com/timu3_id_64477[举报]
元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分.现请针对表中的A~I种元素,回答问题.
(1)根据下列要求,用序号填写:
①最不活泼的元素是
④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是
(2)元素B对应氢化物的水溶液呈碱性的原因是
(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:
(4)写出元素G的单质与NaOH反应的离子方程式:
查看习题详情和答案>>
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I |
①最不活泼的元素是
H
H
;②金属性最强的元素是I
I
;③氧化物、氢氧化物均具有两性的元素是E
E
;④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是
A
A
.(2)元素B对应氢化物的水溶液呈碱性的原因是
NH3?H2O NH4++OH-
NH4++OH-
 NH4++OH-
NH4++OH-NH3?H2O NH4++OH-
NH4++OH-
(用电离方程式表示). NH4++OH-
NH4++OH-(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:
2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
;②元素F的氧化物与NaOH溶液反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(4)写出元素G的单质与NaOH反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.元素周期表是学习化学的重要工具,它隐含许多信息和规律.
(1)以下为元素周期表的一部分,写出表中c、d的元素符号:c
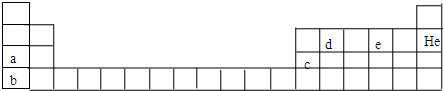
(2)用元素符号标出硫在周期表中对应的位置.
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是
(4)写出c的氧化物与硫酸反应的离子方程式:
b元素的单质与e的氢化物(分子中含三个原子核)反应的化学方程式为
查看习题详情和答案>>
(1)以下为元素周期表的一部分,写出表中c、d的元素符号:c
Al
Al
dC
C

(2)用元素符号标出硫在周期表中对应的位置.
(3)相同大小的a、b两种元素的单质分别投入热坩埚中,反应较剧烈的是
K
K
(用化学式表示,下同).(4)写出c的氧化物与硫酸反应的离子方程式:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.b元素的单质与e的氢化物(分子中含三个原子核)反应的化学方程式为
2K+2H2O═2KOH+H2↑
2K+2H2O═2KOH+H2↑
.元素周期表是学习化学的重要工具.下表为8种元素在周期表中的位置.
(1)下图所示的模型表示的分子中,可由A、D形成的是

(2)比较M、R元素的非金属性:
(3)Q元素在周期表中的位置是第
 .
.
(4)Na在R的单质气体中燃烧产物的电子式为
 ,Na在F单质中燃烧的产物是
,Na在F单质中燃烧的产物是
(5)上述元素的最高价氧化物的水化物中,碱性最强的是
(6)比较Na、G、Q 3种元素的金属性:Na>
查看习题详情和答案>>
| A | |||||||||||||||||
| D | F | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| N | |||||||||||||||||
acd
acd
(填选项序号).
(2)比较M、R元素的非金属性:
Cl
Cl
>S
S
(填元素符号).(3)Q元素在周期表中的位置是第
三
三
周期ⅢA
ⅢA
族,其原子结构示意图为

(4)Na在R的单质气体中燃烧产物的电子式为


Na2O2
Na2O2
(填化学式).(5)上述元素的最高价氧化物的水化物中,碱性最强的是
KOH
KOH
(填化学式),其与Q的单质反应的离子方程式是2Al+2OH-+2H2O=2AlO-2+3H2↑
2Al+2OH-+2H2O=2AlO-2+3H2↑
.(6)比较Na、G、Q 3种元素的金属性:Na>
Mg
Mg
>Al
Al
(填元素符号),能证明其金属性强弱的实验依据是比较与水或与酸反应置换出氢气的难易程度(或比较最高价氧化物对应的水化物的碱性强弱)
比较与水或与酸反应置换出氢气的难易程度(或比较最高价氧化物对应的水化物的碱性强弱)
.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下面是八种短周期元素的相关信息(已知铍的原子半径为0.089nm)
F原子中无中子,G最高正价数与负价数相等,且最外层电子数是次外层的二倍,H元素单质焰色反应呈黄色
(1)B元素在元素周期表中的位置
(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
查看习题详情和答案>>
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
(1)B元素在元素周期表中的位置
第三周期第ⅢA族
第三周期第ⅢA族
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是
HClO4
HClO4
(填化学式).(3)写出B的单质和H的最高价氧化物对应水化物反应的离子方程式:
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
.(4)H、E形成原子个数比为1:1的化合物含有的化学键类型为
离子键和非极性键
离子键和非极性键
.(5)A、B、C、D四种元素的原子半径由小到大的顺序为(填元素符号)
Cl<S<Al<Mg
Cl<S<Al<Mg
. 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )