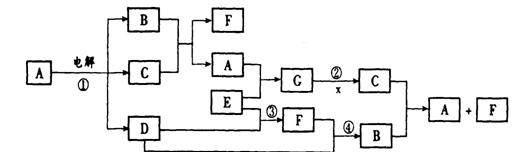
20.二甲醚(CH3OCH3)是一种新型的合成“柴油”。它可由生物甲烷或天然气合成。
 (1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
(1)生物甲烷是由植物和动物粪便在一定条件下发酵而得的甲烷:
(C6H10O5)n+nH2O 3nCH4↑+3nCO2↑,若某植物纤维素(C6H10O5)n的含量为10%,某沼气池,当加入该植物162kg,在微生物作用下完全转化可得CH4在标准状况下的体积为__________________m3。
(2)合成二甲醚主要步骤为造气和合成。过程如下:
|
|

若造气时,设每步转化率均为100%,设某天然气中只含5%CO2,不含其它杂质,每100m3天然气,应同时通入水蒸气和空气各多少体积(空气只含N2和O2且体积比为4:1,下同),才能保证合成时CO和H2充分利用。V[H2O(g)]=________m3;V(空气)=_________m3。
(3)为了充分利用反应过程中生成的比较纯净的氮气,某企业用天然气为主要原料联合生产二甲醚和氨,过程如下:
制气设备:①CH4+H2O→CO+3H2 ②2CH4+O2→2CO+4H2
合成塔I:CO+2H2→CH3OH,2CH3OH→CH3OCH3+H2O;
合成塔II:N2+3H2  2NH3
2NH3
假设天然气中只含CH4,反应②中通入适量空气,通过调节①和②中投入的CH4的量,以使反应①剩余的H2和反应②剩余的N2的体积比恰为3:1,以便合成氨。该企业每生产34tNH3理论上同时可以得到二甲醚多少吨(设工业经多次转化,总转化率假定为100%,设合成塔I中水与CO不反应)?
18.(10分)甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g) CH3OH(g) ΔH
< 0。
CH3OH(g) ΔH
< 0。
Ⅰ.在一定条件下,上述反应在一密闭容器中达到平衡。
(1)体积不变的条件下,下列措施中有利于提高CO的转化率的是 _______(填字母)。
A.升高温度 B.增大压强 C.通入CO D.通入H2
(2)在保证H2浓度不变的情况下,增大容器的体积,平衡____________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的理由是________________________
Ⅱ.原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
|
CO2%-CO%-H2% (体积分数) |
0–30–70 |
2–28–70 |
4–26–70 |
8–22–70 |
20–10–70 |
|||||||||||
|
反应温度/℃ |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
225 |
235 |
250 |
|
|
碳转化率(%) |
CH3OH |
4.9 |
8.8 |
11.0 |
36.5 |
50.7 |
68.3 |
19.0 |
33.1 |
56.5 |
17.7 |
33.4 |
54.4 |
8.0 |
12.0 |
22.6 |
|
CH4 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2.8 |
2.8 |
2.8 |
(3)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:_____________________________________________
(4)为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
|
组别 |
体积分数(%) |
|||
|
CO |
CO2 |
H2 |
N2 |
|
|
第1组 |
19.7 |
0.0 |
59.1 |
21.2 |
|
第2组 |
20.7 |
0.3 |
62.1 |
16.9 |
|
第3组 |
16.9 |
1.3 |
50.7 |
31.1 |
|
第4组 |
19.8 |
5.5 |
59.4 |
15.3 |
|
第5组 |
20.3 |
10.9 |
60.9 |
7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、____________________________________________等。


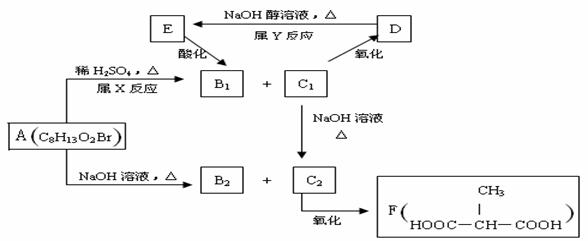
 C2的化学方程式
。
C2的化学方程式
。
 (C4H9)2CuLi
(C4H9)2CuLi C4H9-C2H5
C4H9-C2H5
 B
B