网址:http://m.1010jiajiao.com/timu3_id_54908[举报]
(15分)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体: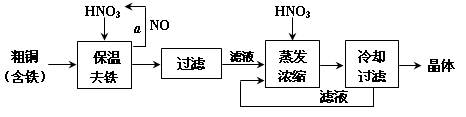
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是
。
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。若调节溶液的pH=4,此时,溶液中c (Fe3+) = 。[已知该条件下,Fe(OH)3的KSP= 4.0×10-36 ]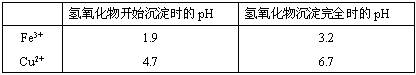
(3)不用加水的方法调节溶液pH的原因是 。
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明) 。
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
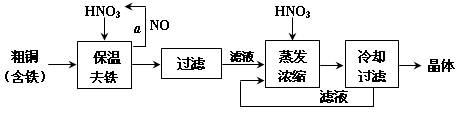
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是
。
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。若调节溶液的pH=4,此时,溶液中c (Fe3+) = 。[已知该条件下,Fe(OH)3的KSP= 4.0×10-36 ]
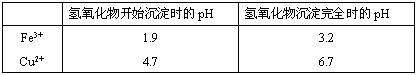
(3)不用加水的方法调节溶液pH的原因是 。
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明) 。
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
查看习题详情和答案>>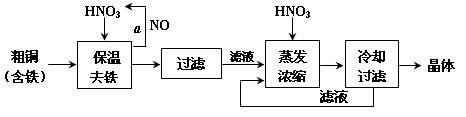
(1)在步骤a中,还需要通入氧气和水,发生反应的化学方程式是
。
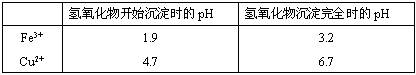
(2)在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。若调节溶液的pH=4,此时,溶液中c (Fe3+) = 。[已知该条件下,Fe(OH)3的KSP= 4.0×10-36 ]
(3)不用加水的方法调节溶液pH的原因是 。
(4)进行蒸发浓缩时,要加适量的硝酸以保持溶液一定的c(H+),其目的是(结合离子方程式简要说明) 。
(5)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
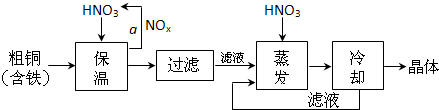
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:

①在步骤a中,还需要通入氧气和水,其目的是________.
②杂质铁与足量稀硝酸反应的离子方程式为________.在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在________范围.
不用加水的方法调节溶液pH的原因是________.
③最后一步所得晶体应采用少量95%酒精淋洗后晾干.用酒精淋洗的优点是________.
(2)下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是________(填字母).

a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离.由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应.Cu与液态N2O4反应制得无水硝酸铜的化学方程式是________.
①在步骤a中,还需要通入氧气和水,其目的是
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3?N
| H | + 4 |
| H | - 2 |