12. (10分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
(10分)某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
[实验1]:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。
[实验2]:将实验1中试管底部的橙黄色沉淀取出,分装在两支小试管中,以后的操作和现象如下:
|
序号 |
操 作 |
现 象 |
|
① |
滴入稀硝酸溶液 |
沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
|
② |
滴入稀硫酸溶液 |
橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
[有关资料]常见铜的化合物颜色如下:
|
物质 |
颜
色 |
物质 |
颜 色 |
|
氯化铜 |
固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 |
氢氧化亚铜 (不稳定) |
橙黄色 |
|
碱式氯化铜 |
绿色 |
氢氧化铜 |
蓝色 |
|
氧化亚铜 |
砖红色或橙黄色 |
氯化亚铜 |
白色 |
请回答下列问题:
(1)铜的常见正化合价为 、 ,最终试管底部橙黄色沉淀的化学式
(2)阴极上发生的反应为:
阳极上发生的反应为:
(3)写出实验2中①、②的离子方程式
①
②
11.(9分)小智同学有次实验时把SO2通入装有BaCl2溶液的试管中,出现了白色浑浊物。
(1)小智查阅了工具书上的相关数据,经过计算推导得出:即使把SO2通入BaCl2溶液中至饱和,也不可能生成BaSO3,故白色浑浊物只能是BaSO4。
你认为他所查阅的数据为:SO2饱和溶液中各离子的浓度和 。
(2)小智对白色浑浊物的成分及产生原因进行了各种合理的假设,并分别设计实验验证假设如下:
|
|
假设 |
实验验证方法及现象 |
|
假设1 |
白色浑浊物是BaSO3。 |
。 |
|
假设2 |
白色浑浊物是BaSO4,造成原因是
。 |
把BaCl2溶液煮沸,冷却后滴加苯液封,再通入SO2。出现轻微浑浊。 |
|
假设3 |
白色浑浊物是BaSO4,造成原因是
。 |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中。 不出现浑浊。 |
请把上表填充完全。
(3)请你再提供一种假设。白色浑浊物是BaSO4,造成原因是 。
(4)写出在验证假设2的实验时,溶液中发生的反应的化学方程式。
、 。
10.(11分)下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属质量/g |
金属 状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因 。
 为了保证溶液达到饱和,实验操作是_______________________。 如果实验过程中把蒸发皿放在空气中冷却,没有在干燥器中冷却,会造成实验结果________(“偏高”、“偏低”、“不变”);使用温度计时仰视温度计刻度读数,会造成实验结果________(“偏高”、“偏低”、“不变”)。
为了保证溶液达到饱和,实验操作是_______________________。 如果实验过程中把蒸发皿放在空气中冷却,没有在干燥器中冷却,会造成实验结果________(“偏高”、“偏低”、“不变”);使用温度计时仰视温度计刻度读数,会造成实验结果________(“偏高”、“偏低”、“不变”)。 (12分) 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2====2MgO+C)
(12分) 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2====2MgO+C) (1)选择制取SO2的合适试剂
。
(1)选择制取SO2的合适试剂
。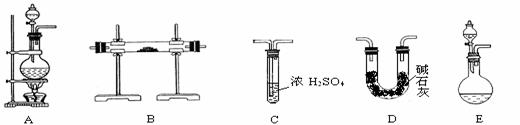 [实验准备]
以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出)。
[实验准备]
以实验室常见仪器(药品)等设计的部分装置如下图(有的夹持和加热仪器未画出)。


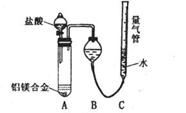

 [探究三]实验方案:称量x g铝镁合金粉末.放在如右图
[探究三]实验方案:称量x g铝镁合金粉末.放在如右图