68.(湛江二模)(11分)我国规定的饮水质量标准必须符合下表要求:
|
pH值 |
6.5-8.5 |
|
Ca2+、Mg2+总浓度 |
<0.045mol/L |
|
细菌总数 |
<100个·mL-1 |
下图是源水处理成自来水的工艺流程图:
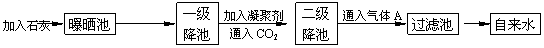

源水中含Ca2+、Mg2+、HCO3-、Cl-等,如加入石灰后再加适量的纯碱,可以除去源水中的____________离子。
凝聚剂除去悬浮固体颗粒的过程_______。(填写序号)
A.只是物理过程 B.只是化学过程 C.是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
(3)通入二氧化碳的目的是___________和___________。
(4)气体A的作用是能____________。这种作用是基于气体A和水反应的产物具有_____性。
(5)下列物质中,______________可以作为气体A的代用品。(填写编号)
①Ca(ClO)2 ②NH3 ③K2FeO4 ④SO2
67.(湛江二模)(13分)某学校研究性学习小组设计实验探究铝等金属的性质:将一小片久置铝片投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,触摸容器知溶液温度迅速上升,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是___________。(填序号)
A.铝与Cl-反应,铝与SO42-不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)铝片表面出现的暗红色物质是______。
(3)放出的气体是________,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的原因是________________________________________。
(4)某同学通过一定的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是_____________________。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
(5)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
|
选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
|
A |
负极 |
NaOH |
2Al-6e-+8OH-=2AlO2-+4H2O |
6H2O+6e-=6OH-+3H2↑ |
|
B |
负极 |
稀盐酸 |
2Al-6e-=2Al3+ |
6H++6e-=3H2↑ |
|
C |
正极 |
浓硝酸 |
Mg+2e-=Mg2+ |
2NO3-+4H+-4e-=2NO2↑+2H2O |
其中正确的是____(填序号),由此推知,金属作电极不仅与本身性质相关,而且与____有关。
 2H2O(l);△H=-142.9kJ·mol-1
2H2O(l);△H=-142.9kJ·mol-1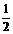 O2(g)
O2(g) 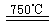 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg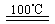 HgBr2+H2
HgBr2+H2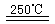 _____ ④2HgO
_____ ④2HgO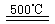 2Hg+O2↑
2Hg+O2↑ 2H2O
2H2O

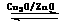 CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示:
CH3OH(g)。甲醇的物质的量与反应温度的关系如下图所示: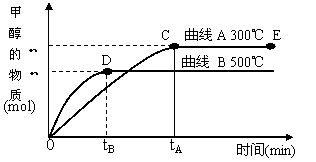

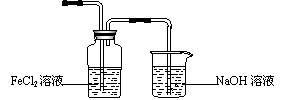

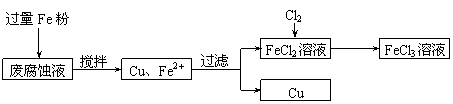

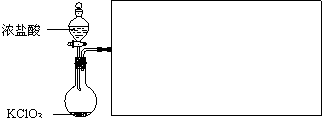



 CH2OH(CHOH)4COOH+H2O+2Ag+4NH3(2分)
CH2OH(CHOH)4COOH+H2O+2Ag+4NH3(2分)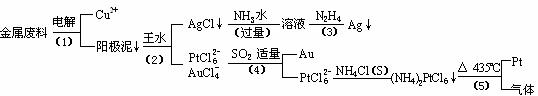
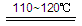 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)