网址:http://m.1010jiajiao.com/timu3_id_399151[举报]
12.如右图,在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器。在Ⅰ、Ⅱ中分别加入2 mol A和2 mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态: 2A十B![]() xC(g),平衡时两容器中A、B、C的物质的量之比均为
xC(g),平衡时两容器中A、B、C的物质的量之比均为
1:3:6。下列说法一定正确的是
A.x的值为3 B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同 [来源:学科网ZXXK]
D.平衡时,Ⅰ容器的体积小于V L
查看习题详情和答案>> xC(g),平衡时两容器中A、B、C的物质的量之比均为
xC(g),平衡时两容器中A、B、C的物质的量之比均为
1:3:6。下列说法一定正确的是
A.x的值为3 B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同
D.平衡时,Ⅰ容器的体积小于V L
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。
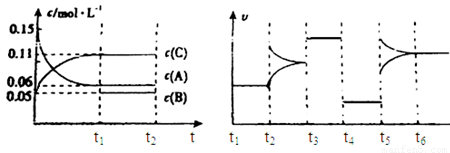
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)= mol/(L∙s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正 v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为 mol;
(4)t1时刻,平衡常数K= ;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式 ;
(6)若t2时刻后图像变化如下图,则改变条件为
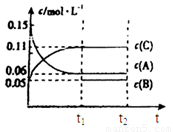
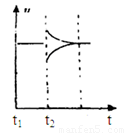
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
查看习题详情和答案>>
(1)判断反应达到平衡状态的依据是
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1

①该反应△H
②实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量.写出该反应的热化学方程式
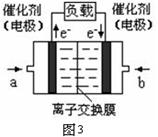
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式
(18分)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是 (填序号)。
a. 生成CH3OH的速率与消耗CO的速率相等
b. 混合气体的密度不变
c. 混合气体的总物质的量不变
d. CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。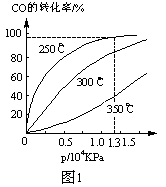
①该反应△H___0(填“>”或“<”)。
②实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A____C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A_____C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。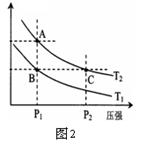
(4)一定条件下,0.5mol甲醇蒸气完全燃烧生成二氧化碳气体和液态水,放出Q KJ的热量。写出该反应的热化学方程式 。
(5)图3是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出 a处电极上发生的电极反应式 。