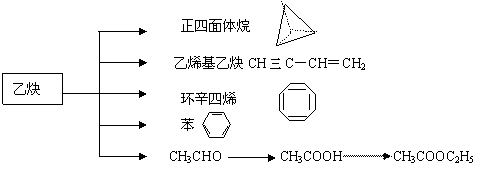
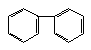
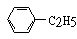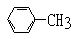(1)凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
(1)凡与醛基直接相连的碳原子上的氢称为α-H原子,在稀碱溶液的催化作用下,一个醛分子上的α-H原子连接到另一个醛分子中醛基的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
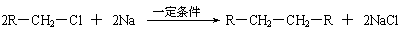 (2)
(2)

(3)
合成路线如下:
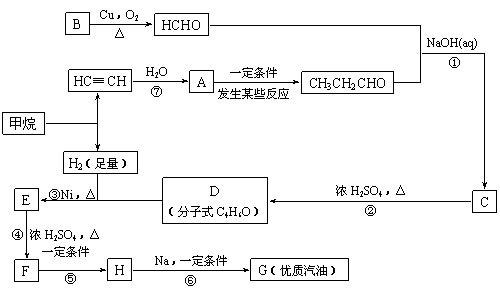
填空:
(1)在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
(2)写出下列反应方程式
E → F: ;
H → G: 。
(3)H也能与NaOH溶液反应,其反应方程式为:
,
生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
28.(10分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处,请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
 |
 |
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)d元素名称为 ,其基态原子的电子排布式为 。
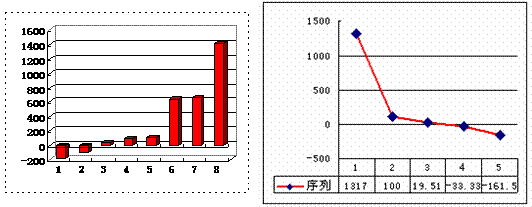
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 (填化学式),是 晶体。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,空间构型为 ;序列“2”的氢化物的结构式为 ,其中心原子的杂化轨道类型是 杂化。
25.(11分)如图:横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:
__________________ 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)== ____ 。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是 ___ 。
(4)往1.00L 1.00mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol
(5)已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
|
C(HCl)/(mol·L-1) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
C(PbCl2)/(mol·L-1)×10-3 |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是 (填字母序号)
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(如配合离子)
D.PbCl2固体可溶于饱和食盐水
22.(9分)在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 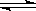 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
|
t℃ |
700 |
800 |
850 |
1000 |
1200 |
|
K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g) 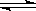 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
|
时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2 O ( mol/L) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
21.(12分)某混合碱是①Na2CO3和NaHCO3 或② Na2CO3和 NaOH。用“双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol•L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
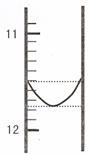 (1)某同学平行滴定了三次,每次滴定从
"0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
(1)某同学平行滴定了三次,每次滴定从
"0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
|
序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
|
I |
? |
26.85 |
|
II |
10.02 |
25.02 |
|
III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
19 .(8分)检查装置气密性是化学实验中的重要操作之一。试按要求回答下列问题:
.(8分)检查装置气密性是化学实验中的重要操作之一。试按要求回答下列问题:
(1)下列仪器或装置在使用前一定要检查气密性的是____(填序号,下同)。
A、容量瓶 B、洗气瓶 C、分液漏斗 D、酸(碱)式滴定管
(2)下列关于不进行气密性检查可能导致后果的叙述中,正确的是____。
A、收集不到气体 B、造成环境污染
C、观察到的实验现象有误 D、引发爆炸事故 ·
(3)为检查右图所示简易气体发生装置的气密性,甲、乙两位同学进行了以
下操作和方案设计。
①甲同学认为,只要往漏斗中加水,便可检验其气密性是否良好。经检验他
的方案可行。则甲同学的操作方法、现象和结论是 。
②乙同学设计的方案是:往漏斗中注人一定量的水至浸没长颈漏头下端。
关闭活塞,用手捂住试管中上部,待漏斗中液面上升一定高度,打开活塞让液面回落后,迅速关闭活塞,松开手,见漏斗中液面低于试管中液面且不再升降,说明气密性良好。乙同学设计方案的原理是 。
20.(11分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如
下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2,请设计实验证明有O2生成。
。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
|
提出问题 |
收集资料 |
提出假设 |
验证假设 |
得出结论 |
|
氯水中何种物质能使湿润的红色布条褪色 |
①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
①
② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
|
 (3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
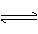
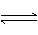 HCO3-
CO32-+H+
Ka2(HCO3-)=5.61×10-11
HCO3-
CO32-+H+
Ka2(HCO3-)=5.61×10-11
HClO H++ClO- Ka(HClO)=2.95×10-8
请依据以上电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中;
②氯气和碳酸钠按照1:1的比例恰好反应;
③将过量的氯气通入到少量的碳酸钠溶液中。
。