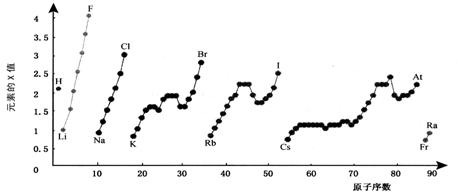
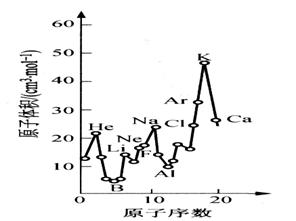
0 38699 38707 38713 38717 38723 38725 38729 38735 38737 38743 38749 38753 38755 38759 38765 38767 38773 38777 38779 38783 38785 38789 38791 38793 38794 38795 38797 38798 38799 38801 38803 38807 38809 38813 38815 38819 38825 38827 38833 38837 38839 38843 38849 38855 38857 38863 38867 38869 38875 38879 38885 38893 447348
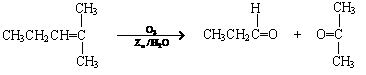

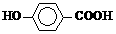
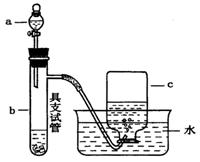
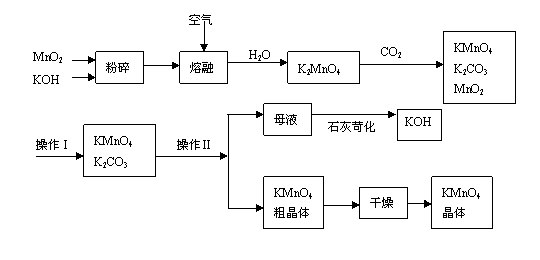

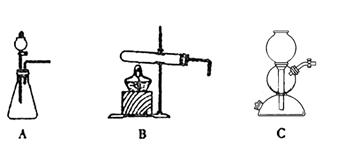
 CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。
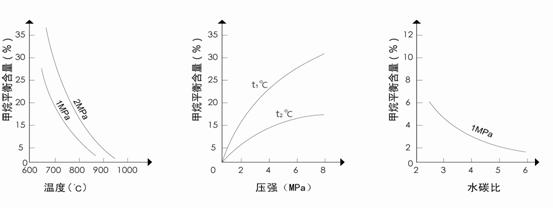
CO(g)+3H2(g),工业上可利用此反应生产合成氨原料气H2。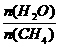 ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图: