19.某学生用NaHCO3,和KHCO3,组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
|
|
50mL 盐酸 |
50mL 盐酸 |
50mL 盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0mol·L
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
 C.加入混合物9.2g时盐酸过量
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
|
三题(共2小题,12分)
16.已知酸性条件下有如下反应:2Cu+=Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下 ( )
|
加入试剂 |
稀硫酸 |
浓硫酸、加热 |
稀硝酸 |
浓硝酸 |
|
实验现象 |
红色固体 和蓝色溶液 |
无色气体 |
无色气体 和蓝色溶液 |
红棕色气体 和绿色溶液 |
由此推出本次氢气还原氧化铜实验的产物是
A.Cu B.Cu2O
C.一定有Cu,可能有Cu2O D.一定有Cu2O,可能有Cu
13.某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
|
时间 |
1 min |
2 min |
5 min |
15 min |
20 min |
|
现象 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
反应1-15min内,铝与盐酸的反应速率变化的可能原因是 ( )
A.该反应是放热反应,温度升高 B.反应过程中盐酸的浓度增大
C.随着反应的进行,铝片表面积变小 D.Cl-离子是该反应的催化剂
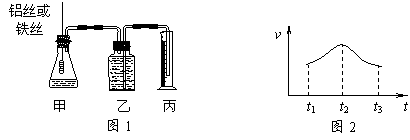
 (2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。右图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;
(2)在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,通常游泳池水的含氯量控制在0.5 mg/L至1.0mg/L之间时,效果最好。右图是该小组测定的每天19∶00时泳池中水的氯含量,哪几天使用泳池不安全 ;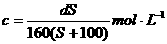 B.
B.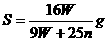
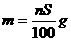 D.
D.
 B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- === SiO32-+H2O
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O
B.碳酸钠溶液中加入二氧化硅:CO32- +SiO2==SiO32- +CO2↑
C.二氧化硅与烧碱溶液反应:SiO2 +2OH- === SiO32-+H2O
D.硅酸与烧碱溶液中和:H2SiO3 +2OH- === SiO32-+2H2O