26、(B)课外活动中做测定CuO和Cu混合粉末中氧化铜质量分数的实验,三组同学设计了三种(混合物质量为m克)方法,第一种在实验中对混合物进行来加热,第二种制取了氢气,第三种将混合物与某种液体进行了反应。
实验可能用到的主要仪器:①托盘天平 ②启普发生器 ③硬质玻璃管
④泥三角 ⑤ 烧杯 ⑥坩埚 ⑦酒精灯 ⑧玻棒 ⑨漏斗 ⑩烘箱
实验可能用到的试剂:a.锌粒 b.稀硫酸 c.氯化钠溶液 d,浓硫酸
请你根据题意选择你认为合适的两种方法,按要求填写表格中的有关内容。
|
实验 方法 |
实验过程中所发生反应的化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的有关 物理量(用文字说明) |
|
第 种 |
|
|
|
|
第 种 |
|
|
|
26、(A)以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。已知:MgCl·6H2O晶体在空气中加热时,释出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热能制得无水MgCl2。
可选用药品:MgCl2·6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。 仪器:见下图(装置可重复使用)



A B C D E
(1)实验室制取氯化氢气体的化学方程式 。
(2)按氯化氢气流的方向,由上图中选择合理装置,按字母填入括号,按照选择的装置,从可选药品中选择合理药品填入表中,并在表中注明所选装置和药品的作用。
|
|
氯化氢气流方向 |
||||
|
装置 |
|
|
B |
D |
|
|
药品 |
不填 |
浓硫酸 |
|
|
稀NaOH |
|
作用 |
不填 |
|
不填 |
|
|
(3)如果要测定MgCl2·6H2O中的结晶水的数目,需要直接测量的有关物理量(用文字说明) 。
23、(A)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
单质能与水剧烈反应,所得溶液呈强碱性 |
|
B |
最外层电子数是次外层电子数的3倍 |
|
C |
L层有三个未成对电子 |
|
D |
元素最高正价是+7价 |
(1)写出A与水反应的化学方程式 ______________________ 。
(2)元素A与元素D形成一种化合物AD,写出该化合物的电子式 (用元素符号表示)
(3)元素B与元素C相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
A.常温下B的氢化物和C氢化物状态不同
B.原子半径B大于C
C.一定条件下B和C的单质能发生反应,C被氧化。
(4)探寻物质的性质差异性是学习的重要方法之一。A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是 (用元素符号表示),理由 。
(B)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
单质能与水剧烈反应,所得溶液呈弱酸性 |
|
B |
L层p电子数和s电子数相等 |
|
C |
第二周期元素的原子中半径最大 |
|
D |
M层有两个未成对电子 |
(1)写出A与水反应的化学方程式 。
(2)元素B和氢元素形成化合物H4B,写出该化合物的电子式 。
(3)元素A与元素D相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是
A、常温下A单质的颜色比D单质的颜色深。
B、A的气态氢化物比D的气态氢化物稳定
C、离子半径,A大于D
(4)探寻物质的性质差异性是学习的重要方法之-。A、B、C、D四种元素的单质中化学性质明显不同于其他三种单质的是 (用元素符号表示),理由 。
 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)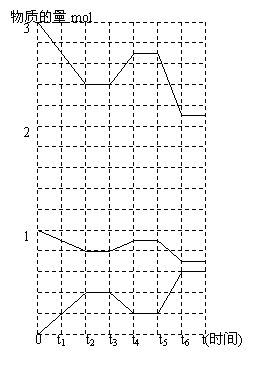
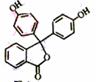 指示剂酚酞的结构简式如下图,下列说法正确的是
指示剂酚酞的结构简式如下图,下列说法正确的是
 能力:SO42->SO32->CO32- D、离子半径:Cl->F->Na+>Al3
能力:SO42->SO32->CO32- D、离子半径:Cl->F->Na+>Al3