31.Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂。工业上制得的Na2S2O3·5H2O晶体中可能含有少量的Na2SO3和Na2SO4杂质。为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶液30mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出。(Na2S2O3+H2SO4→Na2SO4+SO2↑+S↓+H2O)
(1)测得有关实验数据如下(标准状况):
|
|
第一份 |
第二份 |
第三份 |
|
样品的质量/g |
7.54 |
15.08 |
35.00 |
|
二氧化硫的体积/L |
0.672 |
1.344 |
2.688 |
|
硫的质量/g |
0.8 |
1.6 |
3.2 |
(摩尔质量:Na2S2O3·5H2O 248g/mol ;Na2SO3 126g/mol;Na2SO4 142 g/mol)
计算所用硫酸溶液的物质的量浓度。
(2)分析以上实验数据,该样品中(填写选项字母) 。
A 仅含有Na2S2O3·5H2O
B 含有和Na2S2O3·5H2O和Na2SO3,无Na2SO4
C 含有Na2S2O3·5H2O、Na2SO3和Na2SO4
(3)若将30.16g该样品和一定量的上述硫酸溶液混合微热。试讨论:当加入硫酸的体积(aL)在不同取值范围时,生成的SO2体积(bL)的值(可用含a的关系式表示)。
27.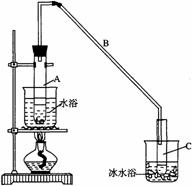 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: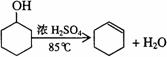
|
|
密度
(g/cm3) |
熔点
(℃) |
沸点
(℃) |
溶解性 |
|
环己醇 |
0.96 |
25 |
161 |
能溶于水 |
|
环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__________,导管B除了导气外还具有的作用是__________。
②试管C置于冰水浴中的目的是___________________________________________。
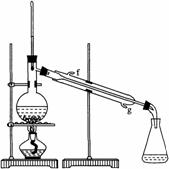 (2)制备精品
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________(填入编号)洗涤。
A KMnO4溶液 B 稀H2SO4 C Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A 蒸馏时从70℃开始收集产品 B 环己醇实际用量多了
C 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A 用酸性高锰酸钾溶液 B 用金属钠 C 测定沸点
25.下表是元素周期表的一部分,表中所列字母分别代表一种元素。
|
a |
|
|
|||||||||||||||
|
|
|
|
|
b |
c |
d |
e |
|
|||||||||
|
f |
|
g |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
i |
回答下列问题:
(1)以上指定元素形成的单质中,熔点最低的是________(填化学式);
(2)由a、c、d三种元素形成的化合物中,能促进水电离的是________(填其中一种物质的化学式),能抑制水电离的是_________(填其中一种物质的化学式)。
(3)e元素位于周期表中第____周期____族。b、c、d、e、h元素的氢化物中,热稳定性最大的是_____(填氢化物的化学式)。
(4)f、g元素的单质共5.0 g在100 mL水中完全反应,生成的溶液中只含有一种溶质分步写出发生反应的化学方程式:
① ____ ___ ②
所得溶液的物质的最大浓度为 mol/L。(液体的体积变化忽略不汁)
 生产工程塑料PBT( )的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。
生产工程塑料PBT( )的重要原料G(1,4-丁二醇),可以通过下图三种不同的合成路线制备。又知B的所有原子处于同一平面。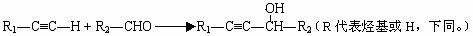
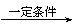 Ⅱ.2R-Cl+2Na
R-R+2NaCl
Ⅱ.2R-Cl+2Na
R-R+2NaCl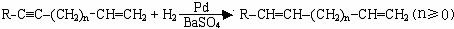 Ⅳ.
Ⅳ.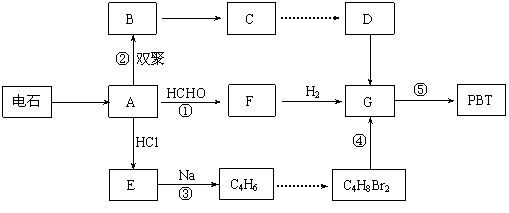
 提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:
 B C
…… G
B C
…… G (2) 某烃的组成为C15H24,分子结构非常对称。有关实验证实该烃中仅存在三种基团:乙烯基(-CH=CH2)、亚甲基(-CH2-)、次甲基(-CH-),并且乙烯基和次甲基之间必须通过亚甲基相连,相同基团之间不相连。
(2) 某烃的组成为C15H24,分子结构非常对称。有关实验证实该烃中仅存在三种基团:乙烯基(-CH=CH2)、亚甲基(-CH2-)、次甲基(-CH-),并且乙烯基和次甲基之间必须通过亚甲基相连,相同基团之间不相连。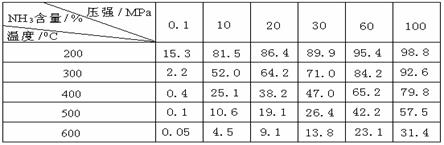 工业合成氨时将N2和H2按体积比为1 :3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1 :3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表: (2)根据表中数据,画出在30MPa下,
(2)根据表中数据,画出在30MPa下,