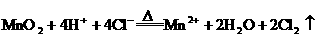24 .(8分)
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物:
②Y和Z属同族元素,它们能形成两种常见化合物
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。
请回答:
(1)W元素是 ;Z元素是 。
(2)化合物WY和WX2的化学式分别是 和 。
(3)Y和Z形成的两种常见化合物的分子式是 和 。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式: 。
25 (8分)
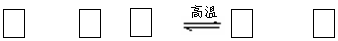 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K= ;
(4)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
26 (8分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+
Ba2+ |
|
阴离子 |
OH- Cl- CO32-
HSO-4 |
分别取它们的水溶液进行实验。结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是
A ;B ;C ;D
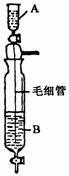
21 (6分)在Inorganic Syntheses一书中,有一装置是用以制备某种干燥的纯净气体,如下图所示:其A中应盛放一种密度比B中密度小的液体。下表中为几种液体的密度
|
溶液名称 |
浓盐酸 |
浓硫酸 |
浓氨水 |
浓氢氧化钠溶液 |
浓醋酸 |
|
密度(g/mL) |
1.19 |
1.84 |
0.89 |
1.41 |
1.06 |
现从上述液体中选出几种适宜的试剂来利用该装置制出干燥纯净气体.
(1)制备出的气体其化学式是 。(写出全部可以制备的气体)
(2)应选用的试剂:A中盛 ;B中盛 。(任写一组)
(3)装置中毛细管的作用是 。
22 (14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
|
反应结束后分离出溶液备用 |
 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是 。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2
溶解产生Mn2+,该反应的离子方程式是 。
23 (14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1) 溴在周期表中位于第_________周期,_________族。
(2) 步骤①中用硫酸酸化可提高Cl2的利用率,为什么? 。
(3) 步骤④的离子方程式:________________________________________ 。
(4) 步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-900C。温度过高或过低都不利于生产 ,请解释原因:___________________________________________ 。
(5) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_____________,分离时液溴从分离器的_____(填“上口”或“下口”)排出。
(6)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: 。
 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是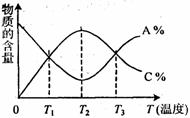 已知可逆反应aA+bB
已知可逆反应aA+bB  Al(OH)3↓
Al(OH)3↓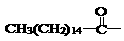 后,苦味消失,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是
后,苦味消失,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是 、第七周期 B 镭、第七周期 C 铼、第六周期 D 氡、第六周期
、第七周期 B 镭、第七周期 C 铼、第六周期 D 氡、第六周期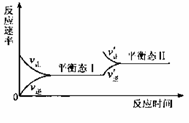
 还原为N2,从而消除污染。
还原为N2,从而消除污染。 □N2↑+□Al(OH)3+□OH-
□N2↑+□Al(OH)3+□OH- 高三年级第一次月考
高三年级第一次月考 g/cm3,阿伏加德罗常数为NA,则食盐晶体中两个距离最近的氯离子间的距离为____________cm。
g/cm3,阿伏加德罗常数为NA,则食盐晶体中两个距离最近的氯离子间的距离为____________cm。