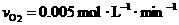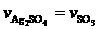25. (12分) 表中所列是周期表ⅥA族(氧族元素)的主要元素,表中内容为该族元素的部分性质。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
452 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是 。
(2)碲的化合价可能有 。
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是 (填化学式)。
(4)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为 。
(5)工业上Al2Te3可用来制备H2Te,完成并配平下列化学方程式:
____A12Te3 + ______ ( ) = ______ A1(OH)3↓+ ______H2Te↑
(6)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_________________________________。
 (7)右图所示为氧族元素单质与H2反应过程中的能量
(7)右图所示为氧族元素单质与H2反应过程中的能量
变化示意图,其中a、b、c、d分别表示氧族中某一元素
的单质,△H为相同物质的量的单质与H2反应的反应热。
则:b代表 ,d代表 (均写单质名称)。
23.(14分)某研究性学习小组在探究铜锌与浓盐酸反应,设计了如下实验方案:
实验用品:纯锌片,37%的浓盐酸,铜片,蒸馏水,氯化铜溶液。
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。
|
||
|
根据上述资料与交流材料回答下列列问题
(1)乙反应速率明显比甲快,原因是: 。
(2)丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比甲大的事实,作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理 ,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
|
丁猜想 |
验证方法 |
预测现象及结论 |
|
丁认为铜片中 可能含有锌等杂质 |
|
|
(3)戊注意到乙的交流卡片记录的第(3)条现象中的白色沉淀。
分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料卡片中的①②大胆猜想,白色沉淀是生成的氯化亚铜。
请你帮他设计验证方案(若有多个只设计一个方案):
|
戊猜想 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀是 氯化亚铜 |
|
|
(4)乙的实验步骤(3)中,将反应后的溶液,隔绝空气,加入适量水,出现白色沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。


 ②F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;I的分子式为C9H14O6。
②F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;I的分子式为C9H14O6。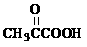
 (6分)水的电离平衡如右图所示。
(6分)水的电离平衡如右图所示。
 Cu2O(红色) + CH3COOH + 2H2O
Cu2O(红色) + CH3COOH + 2H2O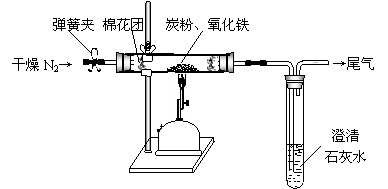 (2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。 Ag2O(s) + SO3(g),2SO3(g)
Ag2O(s) + SO3(g),2SO3(g)