8、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态。图甲 是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:_________________
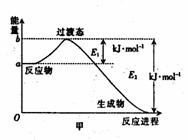 _____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
_____________(△H用含E1和E2的代数式表示,其中E1、E2均大于0)。
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙)。当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁)。
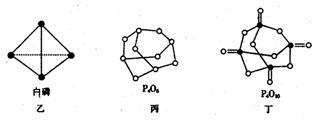
请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/kJ·mol-1 |
198 |
360 |
498 |
X |
已知白磷(P4)的燃烧热为2982 kJ·mol-1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=_____________。
(1)P4(s) + 5O2(g) === P4O10(s); △h=-(E2-E1)kJ·mol-1(2分)
(3)585(2分)
(4)发638kJ·mol-1(2分)
6、不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键元素间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键元素间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
电负性值 |
0.98 |
1.57 |
2.04 |
2.55 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
观察上述数据,回答下列问题:
(1)通过分析电负性值变化规律,确定Mg元素电负性值的最小范围 。
(2)请归纳元素的电负性和金属、非金属的关系是 ;
(3)某有机化合物结构中含S-N键,其共用电子对偏向 (写原子名称)。
(4)从电负性角度,判断AlCl3是离子化合物,还是共价化合物的方法是:(写出判断的方法和结论) ;请设计一个实验方案证明上述所得到的结论: 。
(1)0.93-1.57
(2)非金属性越强,电负性越大,金属性越强,电负性越小 (3)氮原子
(4)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物;
将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物。
5、现有下列短周期元素性质的数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
1.43 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
|
–2 |
|
|
–3 |
–1 |
|
–3 |
|
试回答下列问题:
(1)上述元素中处于第VA族的有 ,处于第二周期的有 (以上均用编号表示)。
(2)上述元素中金属性最强的是 (用编号表示)。
(3)写出元素①、⑧形成的化合物与KOH溶液反应的化学方程式 。
(4)经验表明,除氢和氦外,当元素原子的电子层数(n)多于或等于原子最外层电子数(m)即(n–m)≥ 0时,该元素属于金属元素;当元素原子的最外层电子数(m)多于原子的电子层数(n)即(n–m)< 0时,该元素属于非金属元素。试回答:
a.第n(n≥ 2)周期有 种非金属元素(含零族元素)。
b.根据周期表中每个周期非金属元素的种数,预测周期表中应有 种非金属元素(含零族元素)。还有 种未发现,未发现的非金属处在第 周期第
族(注:将零族看作VIIIA族)。
(1)④和⑦(1分)①③⑦(1分) (2)⑥(1分)
(3)Al2O3+2KOH→2KAlO2+H2O(2分)
(4)8–n(1分)。23种(1分),1种(1分),七和VIIIA族(答对其中1个得1分)
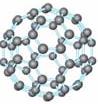 20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
20世纪80年代日本科学家应用电子计算机模拟出结构类似于C60(分子结构如右图所示)的物质N60,计算机模拟结果显示,N60与C60有相似的结构但稳定性较差。科学家预测,将N2进行冷冻或加压,然后运用高强度激光照射能转变为N60分子团,该分子团具有极强的挥发性,在受热情况下瞬间分解为N2并释放出大量的能量。
 NH3·H2O+H+;
NH3·H2O+H+;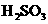 ,(2分)
,(2分)
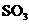 ,(2分)
,(2分) 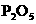 ,(2分)
,(2分)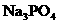 、
、 ,(2分)
,(2分) 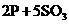
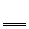
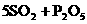 (2分)
(2分) ⑴S2-+H2O HS-+OH- HSO3-+H+=H2O+SO2↑
⑴S2-+H2O HS-+OH- HSO3-+H+=H2O+SO2↑