12.在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是 ( )
A.铝热剂就是单指Fe2O3粉和铝粉的混合物
|
C.分别还原amol Fe2O3所需H2、A1、CO的物质的量之比为3:2:3
D.明矾属硫酸盐,含结晶,是混合物
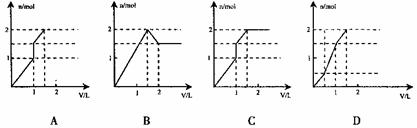 13.向含1 mol HCl和l mol MgSO4的混合溶液加入1 mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是 ( )
13.向含1 mol HCl和l mol MgSO4的混合溶液加入1 mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是 ( )
9.能正确表示下列反应的离子方程式是 ( )
|
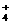 +OH-
+OH- B.Na2CO3溶液中通入少量SO2:2CO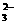 +SO2+H2O
+SO2+H2O 2HCO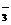 +SO
+SO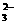
C.CuSO4溶液中加入Ba(OH)2溶液:SO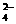 +Ba2+
+Ba2+ BaSO4↓
D.用食醋溶解水垢:CaCO3+2H2+=Ca2++CO2↑+H2O Mg(OH)2+2H+ Mg2++2H2O
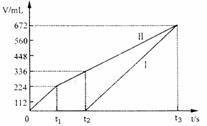 20.(7分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
20.(7分)常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算: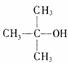 18.(10分)“智能型”大分子在生物工程中有广泛的应用前景。PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离,下列是以物质A为起始反应物合成
18.(10分)“智能型”大分子在生物工程中有广泛的应用前景。PMAA就是一种“智能型”大分子,可用于生物制药中大分子与小分子的分离,下列是以物质A为起始反应物合成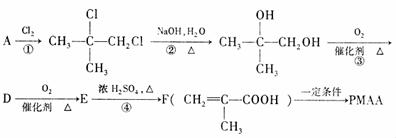
 ②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,
②若电极材料选铜和石墨,电解质溶液选硫酸铁溶液, 现该反庆的装置图(运用题目所给材料和药品)。
现该反庆的装置图(运用题目所给材料和药品)。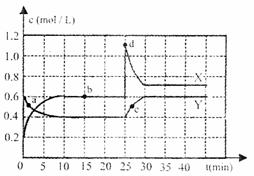 16.(10分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。根据右图,回答下列问题:
16.(10分)已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g);△H<0,现将一定量NO2和N2O4的混合气体通入一体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如右图所示。根据右图,回答下列问题: 近来,科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全,电池总反应为:C2H5OH+3O2 2CO2+3H2O,下列说法不正确的是 ( )
近来,科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全,电池总反应为:C2H5OH+3O2 2CO2+3H2O,下列说法不正确的是 ( ) D.电池正极的电极反应为:4H++O2+4e- 2H2O
D.电池正极的电极反应为:4H++O2+4e- 2H2O