摘要:25. 表中所列是周期表ⅥA族的主要元素.表中内容为该族元素的部分性质. 性质\元素 8O 16S 34Se 52Te 单质熔点(℃) -218.4 113 452 单质沸点(℃) -183 444.6 685 1390 主要化合价 -2 -2,+4,+6 -2,+4,+6 原子半径 逐渐增大 单质与H2反应情况 点燃易化合 加热化合 加热难化合 不能直接化合 请根据表回答下列问题: (1)硒的熔点范围可能是 . (2)碲的化合价可能有 . (3)硫.硒.碲的氢化物水溶液的酸性由强至弱顺序是 . (4)氢硒酸有较强的 (填“氧化性 或“还原性 ).因此放在空气中长期保存易变质.其可能发生的化学方程式为 . (5)工业上Al2Te3可用来制备H2Te.完成并配平下列化学方程式: A12Te3 + = A1(OH)3↓+ H2Te↑ (6)已知在常温下.生成17g H2S放出56.1KJ的热量.试写出硫化氢分解的热化学方程式: . (7)右图所示为氧族元素单质与H2反应过程中的能量 变化示意图.其中a.b.c.d分别表示氧族中某一元素 的单质.△H为相同物质的量的单质与H2反应的反应热. 则:b代表 .d代表 .
网址:http://m.1010jiajiao.com/timu3_id_380417[举报]
元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分.现请针对表中的A~I种元素,回答问题.
(1)根据下列要求,用序号填写:
①最不活泼的元素是
④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是
(2)元素B对应氢化物的水溶液呈碱性的原因是
(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:
(4)写出元素G的单质与NaOH反应的离子方程式:
查看习题详情和答案>>
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I |
①最不活泼的元素是
H
H
;②金属性最强的元素是I
I
;③氧化物、氢氧化物均具有两性的元素是E
E
;④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是
A
A
.(2)元素B对应氢化物的水溶液呈碱性的原因是
NH3?H2O NH4++OH-
NH4++OH-
 NH4++OH-
NH4++OH-NH3?H2O NH4++OH-
NH4++OH-
(用电离方程式表示). NH4++OH-
NH4++OH-(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:
2K+2H2O=2KOH+H2↑
2K+2H2O=2KOH+H2↑
;②元素F的氧化物与NaOH溶液反应的化学方程式:SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.(4)写出元素G的单质与NaOH反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
根据以上信息,回答下列问题:
(1)上述五种元素中电负性最大的是 .(填相关元素的元素符号)
(2)请写出E的电子排布式: .
(3)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 .
(4)请写出B、C的最高价氧化物的水化物相混合反应的离子方程式: .
(5)D和B形成的化合物的水溶液的pH 7(填“>”、“=”、“<”),其原因是 (用离子方程式表示).
查看习题详情和答案>>
| … | A | ||||||
| B | C | D |
(1)上述五种元素中电负性最大的是
(2)请写出E的电子排布式:
(3)A和D的氢化物中,沸点较高的是
(4)请写出B、C的最高价氧化物的水化物相混合反应的离子方程式:
(5)D和B形成的化合物的水溶液的pH
主族元素A、B、C、D、E的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍.A、B单质在常温下均为气体,它们在一定条件下以体积比2:1完全反应,生成物在常温下是液体F.此液体与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子.E的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水.回答下列问题:
(1)写出元素符号A ,C .
(2)E元素的最高价氧化物和盐酸反应的离子方程式为: .
(3)用电子式表示F的形成过程 .在加热的条件下B、D形成的化合物的电子式为 ,其中的化学键的类型为 .
(4)写出一种有A、B、C、D组成的化合物的化学式 .
(5)B的气态氢化物是天然气的主要成分,它的空间结构为 .
查看习题详情和答案>>
(1)写出元素符号A
(2)E元素的最高价氧化物和盐酸反应的离子方程式为:
(3)用电子式表示F的形成过程
(4)写出一种有A、B、C、D组成的化合物的化学式
(5)B的气态氢化物是天然气的主要成分,它的空间结构为
元素周期表是学习物质结构和性质的重要工具,下面是元素周期表的一部分,表中所列字母A、D、E、G、Q、M、R、T分别代表某一化学元素。请用所给元素回答下列问题。
| A | |||||||||||||||||
| D | E | ||||||||||||||||
| G | Q | M | R | ||||||||||||||
| T | |||||||||||||||||
(1)某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为 。
![]() (2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(2)某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号) 。
(3)M、D两种元素形成的化合物含有的化学键类型是 ,其分子是(填“极性”或“非极性”) 分子;A分别与D、E、R形成的分子中,分子间存在氢键的是(填分子式) 。A与D形成分子的空间结构可能是(填序号) 。
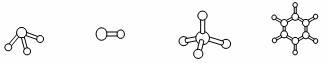
a b c d
图1
(4)从所给元素中组成合适的反应物,用化学方程式表明元素M、R的非金属性强弱:
。
(5)第三周期主族元素单质熔点高低的顺序如图2所示,“1”所代表物质的化学式是 ,“7”所对应的元素形成最高价氧化物的晶体类型是 。

图2
查看习题详情和答案>>
元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分.现请针对表中的A~I种元素,回答问题.
(1)根据下列要求,用序号填写:
①最不活泼的元素是______;②金属性最强的元素是______;③氧化物、氢氧化物均具有两性的元素是______;
④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是______.
(2)元素B对应氢化物的水溶液呈碱性的原因是______(用电离方程式表示).
(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:______;②元素F的氧化物与NaOH溶液反应的化学方程式:______.
(4)写出元素G的单质与NaOH反应的离子方程式:______.
查看习题详情和答案>>
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I |
①最不活泼的元素是______;②金属性最强的元素是______;③氧化物、氢氧化物均具有两性的元素是______;
④第二周期元素中,最高正化合价与最低负化合价绝对值相等的元素是______.
(2)元素B对应氢化物的水溶液呈碱性的原因是______(用电离方程式表示).
(3)写出下列反应的化学方程式:①元素I与水反应的化学方程式:______;②元素F的氧化物与NaOH溶液反应的化学方程式:______.
(4)写出元素G的单质与NaOH反应的离子方程式:______.
查看习题详情和答案>>