1、有关化学量与化学式的计算
 有关物质的量、质量、气体体积、微粒数间的换算
有关物质的量、质量、气体体积、微粒数间的换算
|

|
|
 考查热点
分子式(化学式)、元素的质量分数
化合物中某元素的相对原子质量
考查热点
分子式(化学式)、元素的质量分数
化合物中某元素的相对原子质量

|
 有机物的分子式、结构式
有机物的分子式、结构式
有机反应中量的关系
阿伏加德罗定律及其推论的应用
 掌握基本概念,找出各化学量之间的关系
掌握基本概念,找出各化学量之间的关系
解题策略 加强与原子结构、元素化合物性质、有机物结构性质等相关知识的横向联系
找出解题的突破口,在常规解法和计算技巧中灵活选用
19、通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可
以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ KJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
 请回答下列问题:
请回答下列问题:
⑴ 比较下列两组物质的熔点高低 (填>或<)
SiC______ Si; SiCl4 ______ SiO2
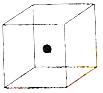
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4
(g) + 2H2(g)  Si(s) +
4HCl(g)
Si(s) +
4HCl(g)
 化学式:正化合价总数=|负化合价总数|
化学式:正化合价总数=|负化合价总数|
 荷总数
荷总数


 氧化还 单一反应:氧化剂得电子总数=还原剂失电子总数
氧化还 单一反应:氧化剂得电子总数=还原剂失电子总数  质及所反应的量
质及所反应的量
 化学反应 离子反应:等号两边离子所带电荷数相等
化学反应 离子反应:等号两边离子所带电荷数相等
 电化学 阳(负)极失电子总数=阴(正)极得电子总数
电化学 阳(负)极失电子总数=阴(正)极得电子总数
 宏观:参加反应 m(反应物)=反应生成 m(生成物)
宏观:参加反应 m(反应物)=反应生成 m(生成物) 过量计算问题的分析讨论
过量计算问题的分析讨论 认真审题,明确是常见综合计算中的哪种类型,寻求解决的合理思路和解决方法
认真审题,明确是常见综合计算中的哪种类型,寻求解决的合理思路和解决方法 运用计算技巧进行化学方程式的有关计算
运用计算技巧进行化学方程式的有关计算 深刻理解化学方程式、热化学方程式的含义,充分利用化学反应前后的有
深刻理解化学方程式、热化学方程式的含义,充分利用化学反应前后的有 氧化产物、还原产物的确定及量的计算
氧化产物、还原产物的确定及量的计算 利用化学反应速率的数学表达式进行计算
利用化学反应速率的数学表达式进行计算 加强对速率概念、平衡移动原理的理解
加强对速率概念、平衡移动原理的理解 有关溶质溶解度的计算
有关溶质溶解度的计算 有关溶解度和溶液浓度的计算,关键要正确理解概念的内涵,理清相互关系一般可采用守恒法进行计算
有关溶解度和溶液浓度的计算,关键要正确理解概念的内涵,理清相互关系一般可采用守恒法进行计算