摘要:有关化学量与化学式的计算 有关物质的量.质量.气体体积.微粒数间的换算 计算 推断 分子式 相对分子质量.各元素的质量分数 计算 考查热点 分子式.元素的质量分数 化合物中某元素的相对原子质量 确定 有机物的通式 有机物的分子式.结构式 有机反应中量的关系 阿伏加德罗定律及其推论的应用 掌握基本概念.找出各化学量之间的关系 解题策略 加强与原子结构.元素化合物性质.有机物结构性质等相关知识的横向联系 找出解题的突破口.在常规解法和计算技巧中灵活选用
网址:http://m.1010jiajiao.com/timu3_id_374123[举报]
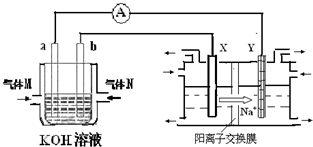 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.Ⅰ(1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量.则表示氢气燃烧热的热化学方程式为:
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
.| 1 |
| 2 |
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极).分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是
负极
负极
(填“正极”或“负极”),气体M的分子式H2
H2
,a电极上发生的电极反应式为:H2+OH--2e-=2H2O
H2+OH--2e-=2H2O
.(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态.则在此电解过程中导线上转移的电子数为
4.14
4.14
mol.(保留小数点后2位)Ⅱ氢气是合成氨的重要原料.工业上合成氨的反应是:
N2(g)+3H2(g)?2NH3 (g)△H=-92.2kJ?mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是
③④
③④
.①N2、H2、NH3的体积分数不再改变;
②单位时间内生成2n mol NH3的同时生成3n mol H2;
③单位时间内生成3n mol N-H键的同时生成n mol N≡N;
④用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤混合气体的平均摩尔质量不再改变;
⑥混合气体的总物质的量不再改变.
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.7
27.7
kJ.②0~1小时内N2的平均反应速率
0.05
0.05
mol?L-1?h-1.③此条件下该反应的化学平衡常数K═
0.15
0.15
(保留两位小数).④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1mol,化学平衡向
正反应
正反应
方向移动(填“正反应”或“逆反应”或“不移动”.)化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答.
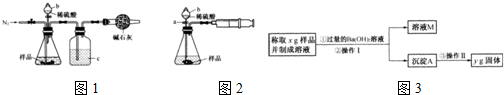
(1)甲同学用图1所示装置测定CO2的质量.实验时稀硫酸是与样品中的
(2)乙同学用图2所示装置,取一定质量的样品(为m g;已测得)和足量稀硫酸反应进行实验,完成样品中Na2CO3”质量分数的测定.
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的
②在实验完成时,能直接测得的数据是CO2的
(3)丙同学用下图所示方法和步骤实验:
①操作Ⅰ涉及的实验名称有
②丙测得的样品中Na2CO3质量分数的计算式为
×100%
×100%.
(4)标准状况下,将672mL CO2气通入50mL 1mol/L KOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)
查看习题详情和答案>>

(1)甲同学用图1所示装置测定CO2的质量.实验时稀硫酸是与样品中的
Na2CO3
Na2CO3
(填“Na2CO3”或“NaCl”)发生反应.仪器b的名称是分液漏斗
分液漏斗
.洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是除去CO2中的水蒸气
除去CO2中的水蒸气
.(2)乙同学用图2所示装置,取一定质量的样品(为m g;已测得)和足量稀硫酸反应进行实验,完成样品中Na2CO3”质量分数的测定.
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的
液面
液面
上升,则装置气密性良好.②在实验完成时,能直接测得的数据是CO2的
体积
体积
(填“体积”或“质量”).(3)丙同学用下图所示方法和步骤实验:
①操作Ⅰ涉及的实验名称有
过滤
过滤
、洗涤;操作Ⅱ涉及的实验名称有干燥、称量
称量
.②丙测得的样品中Na2CO3质量分数的计算式为
| 106y |
| 197x |
| 106y |
| 197x |
(4)标准状况下,将672mL CO2气通入50mL 1mol/L KOH溶液中,完全反应后,所得溶液中K2CO3和KHCO3的物质的量之比为(设反应前后溶液体积变化忽略不计)
2:1
2:1
. 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.I.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池中,下列表达不正确的是
CD
CD
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2
| ||
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol?L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=
1
1
(溶液体积变化忽略不计)II氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1.
(1)下列事实中,不能说明上述可逆反应已达到平衡的是
②③
②③
(填序号)①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N-H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
27.66kJ
27.66kJ
②此条件下该反应的化学平衡常数K=
| 4 |
| 27 |
| 4 |
| 27 |
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向
正反应
正反应
方向移动(填“正反应”或“逆反应”、“不移动”).[化学-选修3:物质结构与性质]
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)砷的基态原子的电子排布式为 .
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主.Ga和As相比,电负性较大的 是 ,GaAs中Ga的化合价为
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;AsH3的沸点高于PH3,其主要原因为
(4)Na3As04可作杀虫剂.As043-的立体构型为 与其互为等电子体的分子的化学式为 (任写一种).
(5)H3As04和H3As03是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比 H3AsO3 酸性强的原因 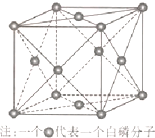
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图.已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为 g/cm3(只要求列算式,不必计算)
查看习题详情和答案>>
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)砷的基态原子的电子排布式为
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主.Ga和As相比,电负性较大的 是
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为
(4)Na3As04可作杀虫剂.As043-的立体构型为
(5)H3As04和H3As03是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比 H3AsO3 酸性强的原因

(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图.已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为
 2C(g)
2C(g) 