摘要:差量法--根据变化前后的差量列比例式计算 解题的一般步骤可分为: ①准确写出有关反应的化学方程式, ②深入细致地分析题意.关键在于有针对性地找出产生差量的“对象 及“理论差量 .该“理论差量 可以是质量.物质的量.气体体积.压强.密度.反应过程中热量的变化等.且该差量的大小与参加反应物质的有关量成正比, ③根据反应方程式.从“实际差量 寻找比例关系.列比例式求解. 例1.充分锻烧黄铁矿W克.反应完全后.冷却到室温.称的固体物质的质量是m g.生成SO2为V升.则黄铁矿中FeS2的含量是(假设矿石中的杂质受热不分解.也不会与SO2反应) A.60V/22.4W×100% B.22.4V/60W×100% C.80V/22.4W×100% D.3(W-m)/W×100% 解析: 本题是考查“差量法 的选择型计算题.设黄铁矿中含FeS2的质量为X.利用固体差可的答案:D 例2.18.4gNaOH和NaHCO3固体混合物.在密闭容器中加热到约250.经充分反应后排出气体.冷却.称得剩余固体质量为16.6g.试计算原混合物中NaOH的质量分数.
网址:http://m.1010jiajiao.com/timu3_id_374129[举报]
| |||||||||||||||||||||||
(2009?汕头二模)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与 I-作用定量析出 I2;I2溶于过量的KI溶液中:I2+I-═I3-;且在溶液中:Fe3++6F-=[FeF6]3-( 六氟合铁(III)络离子 )
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
现准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是
(2)实验中加入稀硫酸,你认为硫酸的作用是
(3)本实验中用碘量瓶而不用普通锥形瓶是因为
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
×100
×100%.
查看习题详情和答案>>
已知:在弱酸性条件下,胆矾中Cu2+与 I-作用定量析出 I2;I2溶于过量的KI溶液中:I2+I-═I3-;且在溶液中:Fe3++6F-=[FeF6]3-( 六氟合铁(III)络离子 )
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
现准确称取ag胆矾试样,置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是
掩蔽Fe3+,防止造成偏大的误差
掩蔽Fe3+,防止造成偏大的误差
; (2)实验中加入稀硫酸,你认为硫酸的作用是
提供酸性条件,抑制Cu2+的水解
提供酸性条件,抑制Cu2+的水解
; (3)本实验中用碘量瓶而不用普通锥形瓶是因为
防止空气中的氧气与碘化钾反应
防止空气中的氧气与碘化钾反应
; (4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
2Cu2++4I-=2CuI↓+I2
2Cu2++4I-=2CuI↓+I2
;(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
| 64cV |
| 1000a |
| 64cV |
| 1000a |
间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:I2+I-═I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用c mol?L-1Na2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
操作:准确称取ag胆矾试样(可能含少量 Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL 3mol?L-1H2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去V mL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是 .
(2)实验中加入硫酸,你认为硫酸的作用是 .
(3)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为: .
(4)下列关于滴定中的操作及说法正确的是 ;
A.在使用滴定管前,应先检查是否漏水,在确保滴定管不漏水后方可使用
B.润洗滴定管时,从滴定管上口加入适量待装溶液,把滴定管夹在滴定管夹上,慢慢放出溶液
C.接近终点时,用蒸馏水冲洗锥形瓶内壁以减小实验误差
D.滴入最后一滴Na2S2O3标准液,溶液变成蓝色,且半分钟内不褪色,即为终点
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= .
查看习题详情和答案>>
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:I2+I-═I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用c mol?L-1Na2S2O3标准溶液滴定:2S2O32-+I3-═S4O62-+3I-.
操作:准确称取ag胆矾试样(可能含少量 Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL 3mol?L-1H2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去V mL标准液.
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是
(2)实验中加入硫酸,你认为硫酸的作用是
(3)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:
(4)下列关于滴定中的操作及说法正确的是
A.在使用滴定管前,应先检查是否漏水,在确保滴定管不漏水后方可使用
B.润洗滴定管时,从滴定管上口加入适量待装溶液,把滴定管夹在滴定管夹上,慢慢放出溶液
C.接近终点时,用蒸馏水冲洗锥形瓶内壁以减小实验误差
D.滴入最后一滴Na2S2O3标准液,溶液变成蓝色,且半分钟内不褪色,即为终点
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
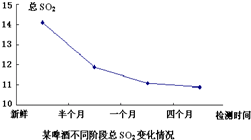 二氧化硫是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.
二氧化硫是啤酒中含量较低而又重要的组分,大部分是在发酵过程中产生的,是啤酒内源抗氧化物的一种,它的存在量与啤酒的抗氧化性有很大的关系.(1)如图是某啤酒样品不同时间阶段总SO2变化情况.
试根据中学所学化学知识分析啤酒样品中总SO2随时间变化的原因之一是
二氧化硫与酒体中溶解氧发生反应转化为SO42-而逐渐减少
二氧化硫与酒体中溶解氧发生反应转化为SO42-而逐渐减少
(2)已知甲醛溶液可吸收二氧化硫生成稳定的羟基甲磺酸:HCHO+H2SO3?HO-CH2-SO4H.该有机反应类型属于
加成
加成
反应.(3)啤酒中的二氧化硫可用碘量法进行测定.其原理是:
第一步:先直接用碘标准溶液(0.01mol/L,下同)滴定啤酒样品(10g)中所有还原性物质消耗碘标准溶液V1mL;
第二步:再另取相同质量的啤酒样品加入足量的甲醛溶液,充分反应后再用碘标准溶液滴定,消耗碘标准溶液V2mL;
根据V1和V2可计算出该啤酒中的二氧化硫含量(g/kg)(提示:①SO2+2H2O+I2=2HI+H2SO4;②羟基甲磺酸、甲醛不与I2反应)
请回答:
①碘标准溶液应用
酸式
酸式
(选填“酸式”或“碱式”)滴定管盛装.②若进行三次平行实验得到V1和V2的平均值分别是:V1=4.75mL;V2=4.25mL.则该啤酒样品中SO2的含量为
0.032
0.032
g/kg.③第二步中加入足量甲醛后约4~6min再进行滴定,若加入甲醛后立即滴定会使测定结果
偏小
偏小
.(选填“偏大”、“偏小”、“不变”)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,Cu2+与I-作用可生成I2,I2溶于过量的KI溶液中:I2+I-=I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用c mol/LNa2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.
操作:准确称取ag胆矾试样(可能含少量Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL 3mol/LH2SO4溶液、少量NaF,再加入足量的10% KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入指示剂,用Na2S2O3标准溶液滴定至终点,共用去V mL标准溶液.回答下列问题:
(1)实验中,加KI前需加入少量NaF,其作用可能是 ;加3mol/LH2SO4溶液的作用可能是 .
(2)滴定实验中所用指示剂是 ;滴定终点的判断方法为 .
(3)本实验中用碘量瓶而不用普通锥形瓶是因为: .
(4)硫酸铜与碘化钾反应后被还原白色的碘化亚铜沉淀,该反应的离子方程式为: .
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= .
查看习题详情和答案>>
已知:在弱酸性条件下,Cu2+与I-作用可生成I2,I2溶于过量的KI溶液中:I2+I-=I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用c mol/LNa2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.
操作:准确称取ag胆矾试样(可能含少量Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL 3mol/LH2SO4溶液、少量NaF,再加入足量的10% KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入指示剂,用Na2S2O3标准溶液滴定至终点,共用去V mL标准溶液.回答下列问题:
(1)实验中,加KI前需加入少量NaF,其作用可能是
(2)滴定实验中所用指示剂是
(3)本实验中用碘量瓶而不用普通锥形瓶是因为:
(4)硫酸铜与碘化钾反应后被还原白色的碘化亚铜沉淀,该反应的离子方程式为:
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=
 I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.
I3-,可用Na2S2O3标准溶液滴定,其反应为:2S2O32-+I3-=S4O62-+3I-.