摘要:有关反应速率.化学平衡的计算 利用化学反应速率的数学表达式进行计算 考查热点 各物质反应速率间的换算 有关化学平衡的计算 加强对速率概念.平衡移动原理的理解 解题策略 将等效平衡.等效转化法等分析推理方法与数学方法有机结合.在采用常规解法的同时.可采用极值法.估算法等解题技巧
网址:http://m.1010jiajiao.com/timu3_id_374125[举报]
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2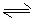 2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K =_________ 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率____________(填“增大”、“不变”或“减小”)。已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率___________(填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
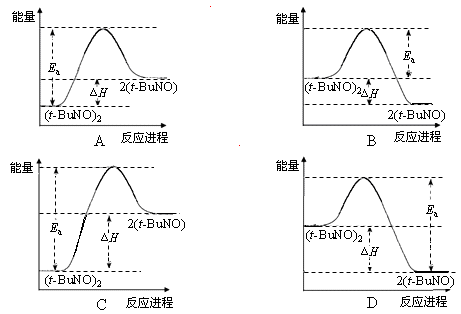
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是_____________。
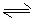 2(t-BuNO) 。
2(t-BuNO) 。(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K =_________ 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率____________(填“增大”、“不变”或“减小”)。已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率___________(填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是_____________。
(4)该反应的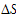 ____ 0(填“>”、“<”或“=”)。在 ________ (填“较高”或“较低”)温度下有利于该反应自发进行。
____ 0(填“>”、“<”或“=”)。在 ________ (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器是 _______ 。
A.pH计B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
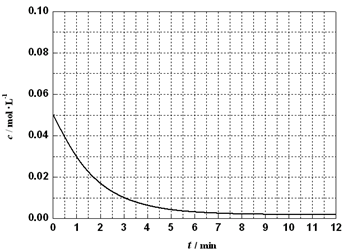
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
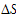 ____ 0(填“>”、“<”或“=”)。在 ________ (填“较高”或“较低”)温度下有利于该反应自发进行。
____ 0(填“>”、“<”或“=”)。在 ________ (填“较高”或“较低”)温度下有利于该反应自发进行。(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器是 _______ 。
A.pH计B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 ![]() 2(t-BuNO) 。
2(t-BuNO) 。
(1)当(t-BuNO)2的起始浓度(c0)为0.50 mol·L-1时,实验测得20℃时的平衡转化率(α)是65 %。列式计算20℃时上述反应的平衡常数K = 。
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3)实验测得该反应的ΔH = 50.5 kJ·mol-1,活化能Ea = 90.4 kJ·mol-1。下列能量关系图合理的是 。

(4)该反应的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率。用于比色分析的仪器 是 。
A.pH计 B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如下图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。

物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2  2(t-BuNO).
2(t-BuNO).
(1)当(t-BuNO)2的起始浓度(c)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%.列式计算20℃时上述反应的平衡常数K=______.
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率______(填“增大”、“不变”或“减小”).
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率______(填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率.
(3)实验测得该反应的△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1.下列能量关系图合理的是______.

(4)该反应的△S______0(填“>”、“<”或“=”).在______(填“较高”或“较低”)温度下有利于该反应自发进行.
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是______.
A.pH计B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
 2(t-BuNO).
2(t-BuNO).(1)当(t-BuNO)2的起始浓度(c)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%.列式计算20℃时上述反应的平衡常数K=______.
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率______(填“增大”、“不变”或“减小”).
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率______(填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率.
(3)实验测得该反应的△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1.下列能量关系图合理的是______.

(4)该反应的△S______0(填“>”、“<”或“=”).在______(填“较高”或“较低”)温度下有利于该反应自发进行.
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是______.
A.pH计B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线.
 查看习题详情和答案>>
查看习题详情和答案>>
(2012?浙江模拟)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2  2(t-BuNO).
2(t-BuNO).
(1)当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%.列式计算20℃时上述反应的平衡常数K=
(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率
(3)实验测得该反应的△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1.下列能量关系图合理的是


(4)该反应的△S
(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是
A.pH计B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线.
查看习题详情和答案>>
 2(t-BuNO).
2(t-BuNO).(1)当(t-BuNO)2的起始浓度(c0)为0.50mol?L-1时,实验测得20℃时的平衡转化率(α)是65%.列式计算20℃时上述反应的平衡常数K=
2.4mol/L
2.4mol/L
.(2)一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率
减小
减小
(填“增大”、“不变”或“减小”).已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率
小于
小于
(填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率.(3)实验测得该反应的△H=50.5kJ?mol-1,活化能Ea=90.4kJ?mol-1.下列能量关系图合理的是
D
D
.

(4)该反应的△S
>
>
0(填“>”、“<”或“=”).在较高
较高
(填“较高”或“较低”)温度下有利于该反应自发进行.(5)随着该反应的进行,溶液的颜色不断变化,分析溶液颜色与反应物(或生成物)浓度的关系(即比色分析),可以确定该化学反应的速率.用于比色分析的仪器是
C
C
.A.pH计B.元素分析仪 C.分光光度计 D.原子吸收光谱仪
(6)通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线.
1、(1)化学反应:I2+2S2O32-=2I-+S4O62-常用于精盐中碘含量测定.某同学利用该反应探究浓度对反应速率的影响.实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择
①1mL 0.01mol?L-1的碘水 ②1mL 0.001mol?L-1的碘水
③4mL 0.01mol?L-1的Na2S2O3溶液 ④4mL 0.001mol?L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=
2、合成氨所需的氢气可用煤和水作原料经多步反应制得,其中某一步反应为:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
200℃时,该反应的平衡常数为
,该温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质浓度(mol?L-1)变化如下表所示:
(1)5min达到平衡时,CO2的浓度为:
(2)欲提高CO的转化率,下列措施中可行的是
a.增加压强 b.降低温度 c.体积不变,再充入CO
d.更换催化剂 e.体积不变,再充入H2O
(3)若5min~10min只改变了某一条件,所改变的条件是:
(4)若某温度下,此反应的平衡常数为1,则该温度
查看习题详情和答案>>
②③④
②③④
(填序号).①1mL 0.01mol?L-1的碘水 ②1mL 0.001mol?L-1的碘水
③4mL 0.01mol?L-1的Na2S2O3溶液 ④4mL 0.001mol?L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=
8.33×10-4mol/(L?s)
8.33×10-4mol/(L?s)
.(结果保留三位有效数字)2、合成氨所需的氢气可用煤和水作原料经多步反应制得,其中某一步反应为:
CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
200℃时,该反应的平衡常数为
| 1 |
| 2.25 |
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
0.004mol/L
0.004mol/L
;CO的平衡转化率为40%
40%
.(2)欲提高CO的转化率,下列措施中可行的是
be
be
(填字母).a.增加压强 b.降低温度 c.体积不变,再充入CO
d.更换催化剂 e.体积不变,再充入H2O
(3)若5min~10min只改变了某一条件,所改变的条件是:
增大水蒸气的浓度
增大水蒸气的浓度
;该条件所改变的量是:增大0.01mol/L
增大0.01mol/L
.(4)若某温度下,此反应的平衡常数为1,则该温度
小于
小于
200℃.(填“大于”、“等于”或“小于”).