(二)填空题
21. 在一密闭容器中,对可逆反应A(气)+B(气) ==== 2C(气)+Q进行五次实验,实验数据记录见下表。
在一密闭容器中,对可逆反应A(气)+B(气) ==== 2C(气)+Q进行五次实验,实验数据记录见下表。
|
实验 次数 |
起始浓度c(mol/L) |
反应条件 |
||||
|
A |
B |
C |
湿度t(℃) |
压强P(Pa) |
催化剂 |
|
|
① |
1 |
5 |
0 |
200 |
1.01×106 |
有 |
|
② |
1 |
5 |
0 |
200 |
1.01×105 |
有 |
|
③ |
|
1 |
0 |
200 |
1.01×106 |
有 |
|
④ |
|
5 |
0 |
20 |
1.01×105 |
有 |
|
⑤ |
|
1 |
0 |
20 |
1.01×105 |
有 |
根据上表提供的数据判断,当反应达到平衡时:
(1)第_______次实验结果A的转化率最大;
(2)第_______次实验结果A的浓度最大;
(3)第_______次实验结果正反应速率最大。
22. 在10℃和2×105Pa条件下,反应aA(气) ==== dD(气)+eE(气)建立平衡后,再逐步增大体系的压强(湿度不变),下表列出不同压强下重新建立平衡时D(气)的浓度CD压强(Pa)2×105 5×105 1×106
在10℃和2×105Pa条件下,反应aA(气) ==== dD(气)+eE(气)建立平衡后,再逐步增大体系的压强(湿度不变),下表列出不同压强下重新建立平衡时D(气)的浓度CD压强(Pa)2×105 5×105 1×106
CD(mol/L)0.085 0.20 0.44
(1)压强从2×105Pa增大到5×105Pa过程中,平衡向_________(填正或逆)反应方向移动,反应方程中化学计量数关系_____________
(2)压强从5×105Pa增大到1×106Pa过程中,平衡向_________方向移动,其合理的解释是_________________
23.
 在重铬酸钾(K2Cr2O7)溶液中的存在如下平衡Cr2O72-+H2O ==== 2HCrO4- ==== 2CrO42-+2H+
在重铬酸钾(K2Cr2O7)溶液中的存在如下平衡Cr2O72-+H2O ==== 2HCrO4- ==== 2CrO42-+2H+
(1)加入H2SO4,使K2Cr2O7溶液的pH值降低,则溶液中[Cr2O72-]与[CrO42-]的比值将_______________(填“增大”、“减小”、“不变”)
(2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH值下降,生成的砖红色沉淀的化学式为____________.
(3)重铬酸钾在酸性溶液中是强氧化剂,例如它在H2SO4存在下把Fe2+离子氧化成Fe3+离子,本身被还原成Cr3+.该反应的离子方程式为_________________
(四)合成氨工业简述
1.原料气的制备、净化
|
|

 物理方法:空气 液态空气
N2
物理方法:空气 液态空气
N2
|

|

|
|
②
|


|
|
 水蒸气 CO+H2
CO2+H2
H2
水蒸气 CO+H2
CO2+H2
H2
反应方程式为:
|
|||
|
|||
|
注意:制得的N2、H2需要净化,清除杂质,以防止催化剂“中毒”。
2.合成氨反应的特点

 化学反应:N2+3H2 2NH3 △H=-92.4KJ
化学反应:N2+3H2 2NH3 △H=-92.4KJ
(1)可逆反应;
(2)正反应是放热反应;
(3)正反应是气体体积缩小的反应。
3.工业合成氨适宜条件的选择
在实际生产中,需要考虑反应速率、化学平衡、原料选择、产量和设备等多方面情况,以确定最佳的生产条件。
(1)温度、压强与化学平衡、反应速率的关系
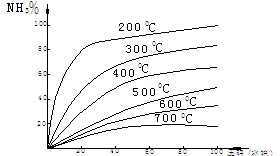
将N2和H2按1:3组成的混合气在不同的温度和压强下长期放置,测得达到平衡时NH3的体积百分比如下图所示.
|
 (a)压强不变时,温度越低,
NH3%越大
(a)压强不变时,温度越低,
NH3%越大
(b)温度不变时,压强越高, NH3%越大
但是又存在如下问题:
a)温度低,反应速率降低.在较低温度下,从N2、H2开始到达平衡要花好几年时间,无实际意义
b)压强增高,对设备、技术、动力等要求相应提高.
适宜条件:①一般采用的压强是 Pa
Pa
②选择适当的催化剂(铁触媒)
 考虑催化剂的活性及反应速率
考虑催化剂的活性及反应速率
选择适当的温度(500℃)
(2)浓度对反应速率、化学平衡的影响
①提高N2或H2的浓度,均可使反应速率增大. 对转化率(a)的影响如下:
 当 CN2 ↗时,则aN2↘,aH2↗
当 CN2 ↗时,则aN2↘,aH2↗
当CH2↗时,则aH2↘,aN2↗
故向循环气中不断补充N2和H2 且N2、H2可循环使用
②当降低NH3的浓度,平衡正移--使生成的氨冷却,成液态分离出.
4. 图示合成氨的原理

(二). 影响化学平衡的因素
 mA(g)+nB(g) pC(g)+qD(g)+Q(放热),△ng=p+q-(m+n)
mA(g)+nB(g) pC(g)+qD(g)+Q(放热),△ng=p+q-(m+n)
  产生的影响
产生的影响条件的改变 |
|
|
|
|
浓 度 |
C(反应物)增大 C(反应物)减小 C(生成物)增大 C(生成物)减小 |
v¢正突增后减,v¢逆渐增,v¢正>v¢逆 v¢正突减后增,v¢逆渐减,v¢逆>v¢正 v¢逆突增后减,v¢正渐增,v¢逆>v¢正 v¢逆突减后增,v¢正渐减,v¢正>v¢逆 |
正移 逆移 逆移 正移 |
|
压 强 |
增 大 压 强 |
△ng<0
v¢正>v¢逆 △ng>0 v¢正、v¢逆均突增 v¢正<v¢逆 △ng=0 v¢正=v¢逆 |
正移 逆移 不移 |
|
减 小 压 强 |
△ng<0
v¢正<v¢逆 △ng>0 v¢正、v¢逆均突减 v¢正>v¢逆 △ng=0 v¢正=v¢逆 |
逆移 正移 不移 |
|
|
温 度 |
升 温 |
v¢正、v¢逆均突增 Q>0, v¢正<v¢逆 Q<0,v¢正>v¢逆 |
逆移 正移 |
|
降 温 |
v¢正、v¢逆均突减 Q>0, v¢正>v¢逆 Q<0, v¢正<v¢逆 |
正移 逆移 |
|
|
催 化 剂 |
正催化剂 负催化剂 |
v¢正、v¢逆同等程度增大 v¢正、v¢逆同等程度减小 |
不移动 |
思考:若在气体混和物中充入惰性气体,对化学平衡的移动有无影响?
解析:应分恒温恒压和恒温恒容两种情况进行讨论.
① 恒温恒压 : 充入惰性气体,密闭容器的体积体积增大,各组分浓度同等程度降低,其效果相当于减小平衡混和物的压强,因此,平衡向反应气体体积增大方向移动。如对合成氨反应来说,则向逆反应方向移动。图象如下:
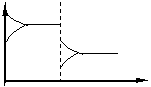
|
V’逆
V’正
② 恒温恒容:充入惰性气体,似乎总压强增大了,但实际上容器体积不变,对平衡混和物各组成浓度不变,即原各气体分压不变,增大的惰性气体的分压与平衡体系无关,所以平衡不发生移动. 图象如下:

V正 V正’= V逆’
V逆
注意
①以上讨论适合于不与平衡混和物各组分反应的多种气体.不一定真为惰性气体。
②如可逆反应前后气态物质总物质的量不变,则化学平衡不受压强影响,上述恒温恒压、恒温恒容两情况都不会使化学平衡移动.
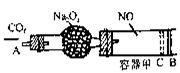 干燥管内装有一定量Na2O2,从气A处缓慢通入
干燥管内装有一定量Na2O2,从气A处缓慢通入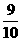 ,随着CO2的继续通入,活塞双
,随着CO2的继续通入,活塞双 把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(固)==== Ca2++2OH-,加入以下溶液,可使Ca(OH)2减少的是( )
把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(固)==== Ca2++2OH-,加入以下溶液,可使Ca(OH)2减少的是( ) B.
B.
 D.
D.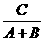
 在容积为20L的真空密闭容器中,充入0.1molH2和0.2mol碘蒸气,加热到t1℃后,发生反应:H2+I2(气) ==== 2HI+Q,测得H2的转化率为50%,再升温到t2℃时,HI的浓度又变成t1℃时的一半,整个过程中体积不变,则在t2℃时混合气体的密度为( )
在容积为20L的真空密闭容器中,充入0.1molH2和0.2mol碘蒸气,加热到t1℃后,发生反应:H2+I2(气) ==== 2HI+Q,测得H2的转化率为50%,再升温到t2℃时,HI的浓度又变成t1℃时的一半,整个过程中体积不变,则在t2℃时混合气体的密度为( ) (2)2NO2(g) ==== N2O4(g)
(2)2NO2(g) ==== N2O4(g) ,故[NO2]亦增大,故体系颜色也加深。
,故[NO2]亦增大,故体系颜色也加深。 N2(气)+3H2(气) 2NH3(气)△H=-92.4KJ。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是 。
N2(气)+3H2(气) 2NH3(气)△H=-92.4KJ。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是 。 例3. 在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol HI(a>b),当反应2HI H2+I2(g)达到平衡后,下列说法正确的是
例3. 在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol及b mol HI(a>b),当反应2HI H2+I2(g)达到平衡后,下列说法正确的是 如图所
如图所 示,则下列叙述正确的是( )
示,则下列叙述正确的是( )
 2NO2
N2O4+Q(放热)
2NO2
N2O4+Q(放热)
 由于在视线所指方向观察颜色深浅主要取决于NO2的浓度,在保持温度不变,增大容器内压强时,最终保持容器体积为原来的1/2时,则NO2的浓度CNO2、容器中压强有如下图示:
由于在视线所指方向观察颜色深浅主要取决于NO2的浓度,在保持温度不变,增大容器内压强时,最终保持容器体积为原来的1/2时,则NO2的浓度CNO2、容器中压强有如下图示: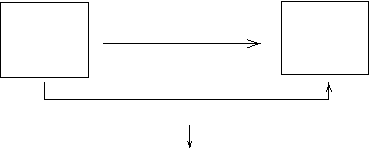 从正、逆反应速度是否相等分析:
从正、逆反应速度是否相等分析: 对于一个一般的可逆反应:aA + bB ==== cC + dD,在平衡状态时,平衡常数K=
对于一个一般的可逆反应:aA + bB ==== cC + dD,在平衡状态时,平衡常数K= ,浓度商Q与K具有相同的表达式,但其浓度(或压力)不像K那样特指平衡态。
,浓度商Q与K具有相同的表达式,但其浓度(或压力)不像K那样特指平衡态。