摘要:(二)填空题 21.在一密闭容器中.对可逆反应A+Q进行五次实验.实验数据记录见下表. 实验 次数 起始浓度c 反应条件 A B C 湿度t(℃) 压强P(Pa) 催化剂 ① 1 5 0 200 1.01×106 有 ② 1 5 0 200 1.01×105 有 ③ 1 0 200 1.01×106 有 ④ 5 0 20 1.01×105 有 ⑤ 1 0 20 1.01×105 有 根据上表提供的数据判断,当反应达到平衡时: (1)第 次实验结果A的转化率最大, (2)第 次实验结果A的浓度最大, (3)第 次实验结果正反应速率最大. 22.在10℃和2×105Pa条件下.反应aA+eE(气)建立平衡后.再逐步增大体系的压强.下表列出不同压强下重新建立平衡时D(气)的浓度CD压强(Pa)2×105 5×105 1×106 CD0.085 0.20 0.44 (1)压强从2×105Pa增大到5×105Pa过程中.平衡向 反应方向移动.反应方程中化学计量数关系 (2)压强从5×105Pa增大到1×106Pa过程中.平衡向 方向移动.其合理的解释是 23.在重铬酸钾(K2Cr2O7)溶液中的存在如下平衡Cr2O72-+H2O ==== 2HCrO4- ==== 2CrO42-+2H+ (1)加入H2SO4.使K2Cr2O7溶液的pH值降低.则溶液中[Cr2O72-]与[CrO42-]的比值将 (填“增大 .“减小 .“不变 ) (2)向K2Cr2O7溶液中加入AgNO3溶液.发生离子互换反应.生成砖红色沉淀且溶液的pH值下降.生成的砖红色沉淀的化学式为 . (3)重铬酸钾在酸性溶液中是强氧化剂.例如它在H2SO4存在下把Fe2+离子氧化成Fe3+离子.本身被还原成Cr3+.该反应的离子方程式为
网址:http://m.1010jiajiao.com/timu3_id_351059[举报]
 (2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.
(2013?日照二模)CO、NO、NO2、SO2等都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题.(1)上述四种气体直接排入空气中会引起酸雨的有
NO、NO2、SO2
NO、NO2、SO2
.(2)NO2可用尿素[CO(NH2)2]还原(尿素中C元素的化合价为+4价),反应的方程式为:4CO(NH2)2+6NO2═7N2+4CO2+8H2O.当消耗掉12g尿素时,转移电子的物质的量是
1.2
1.2
.(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOX),改流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2g?4N2(g)+6H2O(g)△H2=-18070.0kJmol-1
6NO(g)+4NH3(g)?5N2(g)+6H2O(g)△H1=-1627.2kJmol-1
6NO(g)+8NH3(g)?7N2(g)+12H2O(g)△H3=-2659.9kJmol-1
则反应N2g+O2g?2NO(g)的△H=
-179.8
-179.8
kJ.mol-1(4)CO可用于合成甲醇,反应方程式为CO(g)+2H2g?CH3OH(g).在一容积可变的密闭容器中充有10molCO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示.则该反应是△H<
<
0(填“>”或“<”).若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为2
2
L.(5)工业上用氨水将来SO2转化成都(NH4)2SO3,再氧化成(NH4)2SO4.(NH4)2SO4溶液中离子浓度大小顺序为
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
c(NH4+)>c(SO42-)>c(H+)>c(OH-)
;已知25℃时,0.05mol?L-1(NH4)2SO4溶液的pH=a,则c(N
| ||
| c(NH3?H2O) |
1.7×109-a
1.7×109-a
(用含a的代数式表示,已知NH3?H2O的电离常数Kb=1.7×10-5mol?L-1).Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下,当弱电解质达到电离平衡时,溶液中已电离的电解质分子数占原电解质分子总数的百分数)和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。

请回答下面问题:
⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 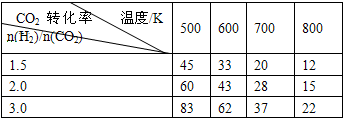
根据表中数据分析:
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

①写出CO和H2制备乙醇的热化学反应方程式_________________。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
查看习题详情和答案>>
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
Ⅰ.描述弱电解质电离情况可以用电离度(电离度:一定条件下,当弱电解质达到电离平衡时,溶液中已电离的电解质分子数占原电解质分子总数的百分数)和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。

请回答下面问题:
⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 
根据表中数据分析:
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

①写出CO和H2制备乙醇的热化学反应方程式_________________。
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
查看习题详情和答案>>
②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。