9(11分)在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) 浓度(mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4) |
0.20 |
C1 |
0.10 |
C3 |
A |
B |
|
c(NO2) |
0.00 |
0.12 |
C2 |
0.22 |
0.22 |
0.22 |
根据本题内容和表格中提供的数据填空(C1、C2、C3、A、B表示相应的浓度)请回答下列各小题:
(1)该反应的化学方程式为 ;达到平衡时四氧化二氮的转化率为 %,表中C2 C3 A (填“<”、“>”=
(2)20s时,四氧化二氮的浓度C1= mol·L-1,在s~20s内四氧化二氮的平均反应速率为 。
(3)若在相同情况下是初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。
[答案](1)N2O4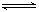 2NO2
(1分) 55% (2分) >(1分) =(1分)
2NO2
(1分) 55% (2分) >(1分) =(1分)
(2)0.14(2分) 3.00×10-3 mol·(L·s)-1(2分)(不写单位不给分)
(3)0.40(2分)
10 (9分) 常温、常压下,A、B、C、D均为气态。A与B可发生可逆反应:A+B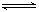 C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中。在不同条件下达平衡时,C的浓度如下:
C+nD。若将2 mol A和2 mol B混合充入体积可变的密闭容器中。在不同条件下达平衡时,C的浓度如下:
|
温度 T/ ℃ |
压强 p/ Pa |
C平衡浓度 c/(mol·L-1) |
|
25 |
1×105 |
1.0 |
|
25 |
2×105 |
1.8 |
|
25 |
4×105 |
3.2 |
|
25 |
5×105 |
6.0 |
(1) 可逆反应中,化学计量数n的取值范围为 ,理由是
。
(2) 在5×105 Pa时,D的状态为 。
[答案] (1) n>1(3分);压强增加到2倍,C的浓度只增加到1.8倍,说明增大压强平衡向左移动,该反应是气体体积增大的反应,故n>1(3分) (2) 液态或固态(3分)
11(12分)对可逆反应aA(g)+bB(g)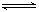 cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系:
cC(g)+dD(g)达到平衡时,各物质的物质的量浓度满足以下关系: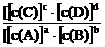 =K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)
=K(为一常数),K称为化学平衡常数,其反应的K值只与温度有关。现有反应:CO(g)+H2O(g)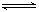 CO2(g)+H2(g)+Q。在850℃时,K=1。
CO2(g)+H2(g)+Q。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”)。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
[解析]
(1)从题给信息知:正反应是放热反应,升温,平衡向逆反应方向移动,CO2和H2的浓度将减少,而CO和H2O(g) 的浓度将增大,故K值减少;
(2)将1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2代入式中,得x=3.0mol<5.0mol,平衡向逆反应方向移动。若要使上述反应开始时向正反应方向进行,则x应满足的条件是:x<3.0mol。
(3)其他物质的投料不变,增加H2的量,平衡向逆反应方向移动,但H2的转化率将减少。
[答案] (1)小于(3分) (2)①逆反应(3分) ②x<3.0(3分)(3)小于(3分)
12(15分)在一定温度下,把4体积SO2和2体积O2通入一个有活塞的体积可变的容器中,活塞一端与大气相通(如图所示)。容器内发生下列反应:2SO2 (g)+O2(g) 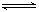 2SO3(g)+热量,当反应达到平衡后,测得混合气体为5体积。
2SO3(g)+热量,当反应达到平衡后,测得混合气体为5体积。
(1) 保持上述温度不变,设a、b、c分别代表初始加入的SO2、O2和SO3气体的体积,如果反应过程达到平衡时,混合气体中各物质的含量仍与上述平衡相同,那么:
① 若a=1.5,c=2.5,则b= 。在此情况下,反应起始时正反应速率将 (填“大于”、“小于”或“等于”)逆反应速率。
② 若欲使起始时逆反应速率大于正反应速率,则c的取值范围为 。
(2) 在反应容器中,若起始时a、b、c值均与(1)相同,但需控制平衡时混合气体为4.5 体积,则可采取的措施是 ,原理是
。
[解析]
(1)①反应物间为系数比关系,故b=0.75。此时总物质的量为1.5+0.75+2.5=4.75<5,要使之达到5,则逆反应速率应大于正反应速率,应填:小于。
② 由 2SO2 (g)+O2(g) 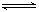 2SO3(g)
2SO3(g)
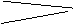
|
1.5 0.75 1.5 故可得c的最大值为4。
欲使起始时逆反应速率大于正反应速率,设c的最小值为w
2SO2 (g) + O2(g) 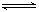 2SO3(g)
2SO3(g)
起始 1.5 0.75 w
变化 2x x 2x
平衡 1.5+2x 0.75+x w-2x
平衡时混合气体总体积:1.5+2x+0.75+x+w-2x=2.25+x+w
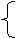
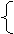 2.25+x+w=5 x=2.75-w
2.25+x+w=5 x=2.75-w
w-2x>0
x<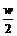
代x<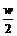 于另一式中,可得3w>5.5,w>1.833,故可得:1.833<c≤4。
于另一式中,可得3w>5.5,w>1.833,故可得:1.833<c≤4。
(2) 降低容器内温度;降低温度使平衡向放热反应方向移动,从而使气体体积减小。
[答案] (1)①b=0.75(2分)小于(3分) ②1.833<c≤4 (5分)
(2) 降低容器内温度(2分);降低温度使平衡向放热反应方向移动,从而使气体体积减小(3分)。
 mol
mol  mol
mol
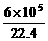 mol
mol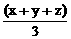 a mol
a mol  在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为( )
在一定条件下,可逆反应X(g)+2Y(g) 2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为( ) pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
( )
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
( )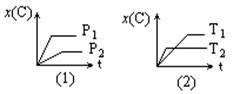 [答案] D
[答案] D