6. 工业制成纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3 ……………………………………………①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl …………………………②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。
请回答:
(1) 工业所制纯碱中常含有少量的氯化钠杂质,其原因是 。
(2) 现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
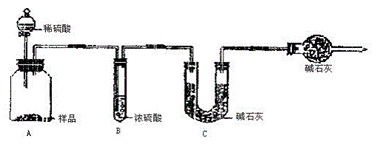
甲组:取10.00 g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
乙组:取10.00 g样品,配成1000 mL溶液,用碱式滴定管量取25.00 mL放入锥形瓶中,加入甲基橙作指示剂,用0.15 mol·L-1的标准盐酸溶液滴定至终点(有关反应为 Na2CO3+2HCl=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00 g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99 g。
请分析、计算后填表:
|
分析与计分 |
计算样品中碳酸钠的质量分数 |
对实验结果的评价 |
实验失败的主要原因及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
/ |
|
丙组 |
|
成功 |
/ |
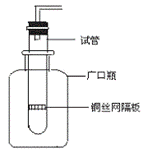 7. (1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体
。若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体 。写出反应的离子方程式:
7. (1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体
。若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体 。写出反应的离子方程式:
。
(2)①写出CO2和Na2O2反应的化学方程式:
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗? 。简要说明理由 。
③该同学无法断定反应中是否有氧气生成,拟使用下列装置进行实验。
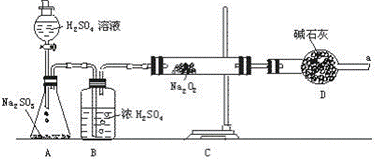
装置中B的作用是 ,D的作用是 。
④为确认反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号) 。
A. 用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧
B. 将C装置中反应后的固体物质溶于适量水配成溶液
C. 在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D. 在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
1. (1)利用图示的装置,选用适当的试剂,完成实验A、B、C把选用的试剂和实验结论填入表格中
|
实 验 |
所用试剂 |
由丙发生的现象所 得实验结论 |
||
|
甲 |
乙 |
丙 |
||
|
A |
|
高锰酸钾 |
|
氧化性Cl2>Br2 |
|
B |
|
硫化亚铁 |
|
|
|
C |
|
|
|
SO2具有漂白性 |
(2)在不增加仪器的条件下,用简便的方法吸收由丙溶液中逸出的有害气体,以防对空气造成污染的方法是 .
(3)在A、B、C三实验制取气体的反应中,属于氧化还原反应的是 ,反应中消耗氧化剂与生成氧化产物的物质的量之比为 。
(4)仍利用该装置和大理石,完成有关D的系列实验请把所需试剂填入表中(每栏只填一种)
|
实 验 |
所用试剂 |
丙产生的现象 |
||
|
甲 |
乙 |
丙 |
||
|
D |
|
|
|
溶液变红 |
|
|
大理石 |
|
溶液中析出白色可溶物 |
|
|
|
|
|
溶液变为乳浊液 |

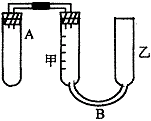 (2)实验室现有药品:一定质量的锌(分片状和粒状两种)1mol/L稀H2SO4、水以及如图装置。图甲、乙两根玻璃管通过橡皮管连通,并装适量的水,甲有刻度(0-100mL),甲、乙管可固定在铁架上,供量气用;乙管可上下移动,以调节液面高低。利用此装置可测量锌的相对原子质量。(设锌全部参加反应,产生气体不超过50mL)。回答下列问题:
(2)实验室现有药品:一定质量的锌(分片状和粒状两种)1mol/L稀H2SO4、水以及如图装置。图甲、乙两根玻璃管通过橡皮管连通,并装适量的水,甲有刻度(0-100mL),甲、乙管可固定在铁架上,供量气用;乙管可上下移动,以调节液面高低。利用此装置可测量锌的相对原子质量。(设锌全部参加反应,产生气体不超过50mL)。回答下列问题: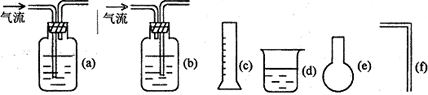
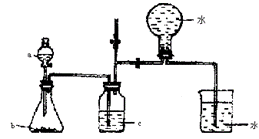 3. (1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
3. (1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
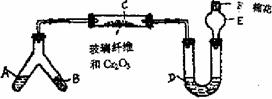 4. 微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点。右图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O
4. 微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点。右图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O NH3↑+H2O ③加热法 ④坩埚、酒精灯(玻璃棒、三脚架)等
NH3↑+H2O ③加热法 ④坩埚、酒精灯(玻璃棒、三脚架)等