摘要:(二). 影响化学平衡的因素 mA+Q 产生的影响 条件的改变 浓 度 C增大 C减小 C增大 C减小 v¢正突增后减.v¢逆渐增.v¢正>v¢逆 v¢正突减后增.v¢逆渐减.v¢逆>v¢正 v¢逆突增后减.v¢正渐增.v¢逆>v¢正 v¢逆突减后增.v¢正渐减.v¢正>v¢逆 正移 逆移 逆移 正移 压 强 增 大 压 强 △ng<0 v¢正>v¢逆 △ng>0 v¢正.v¢逆均突增 v¢正<v¢逆 △ng=0 v¢正=v¢逆 正移 逆移 不移 减 小 压 强 △ng<0 v¢正<v¢逆 △ng>0 v¢正.v¢逆均突减 v¢正>v¢逆 △ng=0 v¢正=v¢逆 逆移 正移 不移 温 度 升 温 v¢正.v¢逆均突增 Q>0, v¢正<v¢逆 Q<0.v¢正>v¢逆 逆移 正移 降 温 v¢正.v¢逆均突减 Q>0, v¢正>v¢逆 Q<0, v¢正<v¢逆 正移 逆移 催 化 剂 正催化剂 负催化剂 v¢正.v¢逆同等程度增大 v¢正.v¢逆同等程度减小 不移动 思考:若在气体混和物中充入惰性气体.对化学平衡的移动有无影响? 解析:应分恒温恒压和恒温恒容两种情况进行讨论. ① 恒温恒压 : 充入惰性气体.密闭容器的体积体积增大.各组分浓度同等程度降低.其效果相当于减小平衡混和物的压强.因此.平衡向反应气体体积增大方向移动.如对合成氨反应来说.则向逆反应方向移动.图象如下: V V’逆 V’正 ② 恒温恒容:充入惰性气体.似乎总压强增大了.但实际上容器体积不变.对平衡混和物各组成浓度不变.即原各气体分压不变.增大的惰性气体的分压与平衡体系无关.所以平衡不发生移动. 图象如下: V正 V正’= V逆’ V逆 注意 ①以上讨论适合于不与平衡混和物各组分反应的多种气体.不一定真为惰性气体. ②如可逆反应前后气态物质总物质的量不变,则化学平衡不受压强影响,上述恒温恒压.恒温恒容两情况都不会使化学平衡移动.
网址:http://m.1010jiajiao.com/timu3_id_351054[举报]
(2013?上海二模)水煤气转化反应CO(g)+H2O(g)?CO2(g)+H2 (g)在一定温度下达到化学平衡状态.
(1)写出该反应的平衡常数表达式K=
.
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
①由实验组1的数据可知,平衡时CO的转化率为
②由实验组1和2的数据可分析,压强对该可逆反应的影响是
③有了实验组1和2的数据,再设计实验组3,其目的是
查看习题详情和答案>>
(1)写出该反应的平衡常数表达式K=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是
bc
bc
(选填编号).a.容器中的压强不变 b.1mol H-H键断裂的同时断裂2molH-O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 3 |
| 2 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 3 | 950 | 1 | 2 | - | - | - |
40
40
%.②由实验组1和2的数据可分析,压强对该可逆反应的影响是
增大压强反应速率加快,增大压强反应物转化率不变,化学平衡不移动
增大压强反应速率加快,增大压强反应物转化率不变,化学平衡不移动
.③有了实验组1和2的数据,再设计实验组3,其目的是
探究温度对该反应平衡的影响,对反应速率的影响
探究温度对该反应平衡的影响,对反应速率的影响
.为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
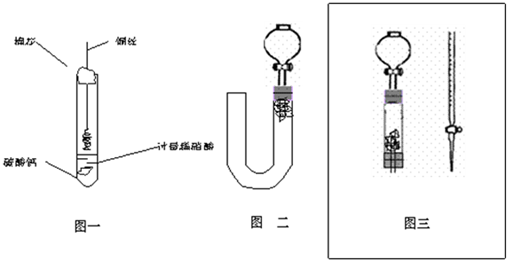
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会
②反应开始后,因为随着NO的体积增加,
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
查看习题详情和答案>>

(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
除去装置内的空气,防止生成的NO被氧化而影响实验效果
除去装置内的空气,防止生成的NO被氧化而影响实验效果
.(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会
因如图所示的铜丝所在空间中被封闭一段空气
因如图所示的铜丝所在空间中被封闭一段空气
而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,
产生的NO排开酸液而与大部分铜丝脱离接触
产生的NO排开酸液而与大部分铜丝脱离接触
影响铜丝与硝酸的继续反应.(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
分液漏斗最大量程刻度处
分液漏斗最大量程刻度处
,设定有条件精确称量,还需要的数据是铜丝反应前后的质量
铜丝反应前后的质量
.(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
(2008?镇江二模)世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、N、S氧化物的排放有增无减,水资源的紧缺和污染加剧.
(1)大气中氟氯烃的减少带来的积极效应是
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:
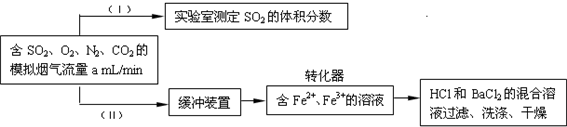
①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
查看习题详情和答案>>
(1)大气中氟氯烃的减少带来的积极效应是
减缓臭氧层空洞的增大
减缓臭氧层空洞的增大
.(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:

②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:

①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
高锰酸钾溶液(或碘水和淀粉的混合液)
高锰酸钾溶液(或碘水和淀粉的混合液)
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数.②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
实验时间
实验时间
和BaSO4的质量
BaSO4的质量
.已知:
①R-NO2
R-NH2;
②+HO-SO3H
SO3H+H2O;
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响.
以下是用苯作原料制备某些化合物的转化关系图:
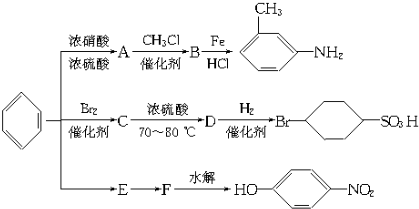
(1)A是一种密度比水 (填“小”或”大”)的无色液体;A转化为B的化学方程式是
.
(2)在“苯
C
D
BrSO3H”中的反应中属于取代反应的是 ,属于加成反应的是 (填字母).
(3)B中苯环上的二氯代物有 种同分异构体;CH3NH2的所有原子 (填“是”或”不是”)在同一平面上.
查看习题详情和答案>>
①R-NO2
| Fe |
| HCl |
②+HO-SO3H
| 70-80℃ |
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响.
以下是用苯作原料制备某些化合物的转化关系图:

(1)A是一种密度比水
(2)在“苯
| a |
| b |
| c |
(3)B中苯环上的二氯代物有
(2012?青浦区二模)许多物质的氧化能力受溶液酸碱性的影响.高锰酸钾在不同条件下发生的还原反应如下:
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH-
MnO4-+e→MnO42-(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H++2e→Mn2++2H2O
(1)MnO2 与稀盐酸不能制取氯气,其原因是
(2)将SO2通入KMnO4溶液中,发生还原反应的过程为
(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列叙述正确的是
a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,其中K2SO4和S的物质的量之比为3:2.完成并配平该反应的化学方程式.
反应若生成5.44g单质硫,反应过程中转移电子的物质的量为
查看习题详情和答案>>
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH-
MnO4-+e→MnO42-(溶液呈绿色)
MnO2的还原反应可表示如下:MnO2+4H++2e→Mn2++2H2O
(1)MnO2 与稀盐酸不能制取氯气,其原因是
MnO2在溶液酸性较强的环境中才有制取氯气的氧化能力
MnO2在溶液酸性较强的环境中才有制取氯气的氧化能力
.(2)将SO2通入KMnO4溶液中,发生还原反应的过程为
MnO4-
MnO4-
→Mn2+
Mn2+
(用化学式或离子符号表示).(3)将PbO2投入到酸性MnSO4溶液中搅拌,溶液变为紫红色.下列叙述正确的是
a
a
(选填编号).a.氧化性:PbO2>KMnO4 b.还原性:PbO2>KMnO4 c.该反应可以用盐酸酸化
(4)将高锰酸钾溶液逐滴加入到硫化钾溶液中可发生如下反应,其中K2SO4和S的物质的量之比为3:2.完成并配平该反应的化学方程式.
28
28
KMnO4+5
5
K2S+24KOH
24KOH
→28
28
K2MnO4+3
3
K2SO4+2
2
S↓+12H2O
12H2O
反应若生成5.44g单质硫,反应过程中转移电子的物质的量为
2.38mol
2.38mol
.