2、提纯下列各组物质,括号内为杂质,填写合适的试剂及方法.
|
混合物 |
加入试
剂 |
分离方法 |
混合物 |
加入试
剂 |
分离方法 |
C 2(HC 2(HC ) ) |
|
|
C2H5OH(CH3COOH) |
|
|
|
CO2(SO2) |
|
|
FeC 2(FeC 2(FeC 3) 3) |
|
|
|
H2S(HBr) |
|
|
Fe2O3(A 2O3) 2O3) |
|
|
|
Na2O2(Na2O) |
|
|
溴苯(溴) |
|
|
|
HNO3(H2SO4) |
|
|
Na2SO4(NH4C ) ) |
|
|
|
K2CO3(KHCO3) |
|
|
NO(NO2) |
|
|
|
SO2(SO3) |
|
|
CH3COOC2H5(乙酸) |
|
|
|
C2H4(SO2) |
|
|
C2H2(H2S) |
|
|
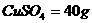 ,求包
,求包