摘要:例1.对于下列二个平衡体系.增大压强时.混合气体的颜色有何变化?) (1)H2(g) + I2 (2)2NO2(g) ==== N2O4(g) 析 根据平衡移动原理.可判断出平衡移动方向.但体系的颜色取决于有色物质的平衡浓度.要比较出第一次平衡时有色气体的浓度与第二次平衡时有色气体平衡浓度的大小.方可得出颜色的变化. 解 析:(1)增大压强.平衡不移动.但缩小了体积.[I2]增大.故体系颜色加深. (2)增大压强.平衡正向移动.[N2O4]增大.由于.故[NO2]亦增大.故体系颜色也加深. 例2. 298K时.合成氨反应的热化学方程式为: N2(气)+3H2(气) 2NH3(气)△H=-92.4KJ.在该温度下.取1 mol N2和3 mol H2放在一密闭容器中.在催化剂存在时进行反应.测得反应放出的热量总是小于92.4KJ.其原因是 . 解析:该反应是可逆反应.在密闭容器中进行将达到平衡.1 mol N2 和3 mol H2不能完全反应生成2 mol NH3 .因而放出的热量总小于92.4KJ. 例3. 在容积相同的两密闭容器A和B中.保持温度为423K.同时向A.B中分别加入a mol及b mol HI.当反应2HI H2+I2(g)达到平衡后.下列说法正确的是 A 从反应开始至达到平衡,所需时间是tA>tB. B 平衡时[I2]A=[I2]B C 平衡时, I2蒸气在混和气体中的体积百分含量A容器中的大于B容器中的 D HI的平衡分解率 aA=aB 解析 本题分析时抓住两个关键: (1)A.B容器中分别加入a mol及b mol HI,则压强Pa>Pb. (2)化学方程式特点是:△Vg=0,故压强变化平衡不移动 根据压强对反应速度的影响,可得∵ PA>PB ∴ VA>VB ∴ tA<tB 根据反应特点.平衡不受压强变化的影响,,A和B容器中I2蒸气的体积百分含量相等. 但注意:平衡状态相同是指在平衡混和物中的百分含量相同,而不是浓度相等,∵PA>PB ∴[I2]A>[I2]B 由于平衡状态相同,当然HI的平衡分解率相同:aA=aB 本题选项D 注意:从本题可进一步明白:若反应速率.平衡浓度改变.但平衡不一定发生移动.而百分含量改变平衡则一定发生移动. 例4.可逆反应2A+B 2C随温度变化气体平均相对分子质量如图所 示.则下列叙述正确的是( ) A.A和B可能都是固体 B.A和B一定都是气体 C.若B为固体.则A一定为气体 D.A和B可能都是气体 解析;从图示可知,升温使反应向平均分子量减小的方向移动.若A和B都是固体 则只有C一种气体.当然分子量不变.若A和B都是气体.则升温平衡逆移.而逆反应方向正是气体物质的量增大的方向.将导致平均分子量减小.但是否A和B一定都是气体呢?不一定!若B为固体.A又不能为固体.当升温平衡逆移.只有当气体质量减小时.才会使平均分子量减小.故此时A一定为气体.本题选项C.D. 巩固练习
网址:http://m.1010jiajiao.com/timu3_id_351057[举报]
有下列二个反应:①Fe(s)+CO2(g)═FeO(s)+CO(g),平衡常数为K1;
②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,CO2的转化率为
(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在
的值最大.
②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数
查看习题详情和答案>>
②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
50%
50%
.(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在
900
900
℃| c(CO) |
| c(H2) |
②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数
40%
40%
.以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:

(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为_____,接触室中发生反应的化学方程式是_____。
(3) 在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是_____。
A. 硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B. 从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C. SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D. SO3用98. 3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4) 下表是压强对SO2平衡转化率的影响

对于SO2转化SO3的反应,增大压强可使转化率______________,但在实际工业生产中常采用常压条件,理由是________________________________。
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是_____t。
查看习题详情和答案>>
有下列二个反应:①Fe(s)+CO2(g)═FeO(s)+CO(g),平衡常数为K1;
②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,CO2的转化率为______.
(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在______℃
的值最大.
②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数______.
查看习题详情和答案>>
②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在______℃
| c(CO) |
| c(H2) |
②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数______.
有下列二个反应:①Fe(s)+CO2(g)═FeO(s)+CO(g),平衡常数为K1;
②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,CO2的转化率为 .
(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在 ℃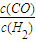 的值最大.
的值最大.
②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数 . 查看习题详情和答案>>
②Fe(s)+H2O(g)═FeO(s)+H2(g),平衡常数为K2.测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.50 | 2.25 |
| 900 | 2.50 | 1.50 |
(2)在一个体积为10L的密闭容器中,加入足量的Fe、FeO粉末,然后:
①再充入CO2和H2O(g)各1mol,控制一定的温度,以上二个反应同时达到平衡.在 ℃
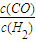 的值最大.
的值最大.②再充入CO22mol和H2 4mol,控制在900℃,以上二个反应达到平衡后,计算平衡时氢气的体积分数 . 查看习题详情和答案>>
对于下列2个反应的说法正确的:
(1)2A2+B2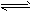 2C (均为无色)______________
2C (均为无色)______________
(2)X2+Y2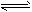 2XY 其中Y2是有色物质_____________
2XY 其中Y2是有色物质_____________
① 若物质均为气体,某物质的浓度、百分含量、物质的量不变了,反应达到了平衡状态
② 若物质均为气体V正(A2)= 2V逆(B2)时反应达到了平衡
③ 若物质均为气体,V逆(X2)= 1/2V正(XY)时反应达到了平衡
④ ①式其他条件不变,若增大压强,平衡逆向移动,说明A、B中至少有一各是固体或液体
⑤ ②式平衡时,c(XY)=0.5mol/L, 若将容器体积扩大到原来的2倍,XY的的浓度变为0.3mol/L,则
X2、Y2中至少有一种是固体或液体。
⑥ 体系的温度不变了反应达到了平衡状态
⑦ 若物质均为气体,体系的颜色不变了,反应达到了平衡状态
⑧ 若物质均为气体,体系的平均分子量不变了,反应达到了平衡状态
查看习题详情和答案>>
(1)2A2+B2
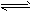 2C (均为无色)______________
2C (均为无色)______________(2)X2+Y2
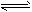 2XY 其中Y2是有色物质_____________
2XY 其中Y2是有色物质_____________① 若物质均为气体,某物质的浓度、百分含量、物质的量不变了,反应达到了平衡状态
② 若物质均为气体V正(A2)= 2V逆(B2)时反应达到了平衡
③ 若物质均为气体,V逆(X2)= 1/2V正(XY)时反应达到了平衡
④ ①式其他条件不变,若增大压强,平衡逆向移动,说明A、B中至少有一各是固体或液体
⑤ ②式平衡时,c(XY)=0.5mol/L, 若将容器体积扩大到原来的2倍,XY的的浓度变为0.3mol/L,则
X2、Y2中至少有一种是固体或液体。
⑥ 体系的温度不变了反应达到了平衡状态
⑦ 若物质均为气体,体系的颜色不变了,反应达到了平衡状态
⑧ 若物质均为气体,体系的平均分子量不变了,反应达到了平衡状态