0 34188 34196 34202 34206 34212 34214 34218 34224 34226 34232 34238 34242 34244 34248 34254 34256 34262 34266 34268 34272 34274 34278 34280 34282 34283 34284 34286 34287 34288 34290 34292 34296 34298 34302 34304 34308 34314 34316 34322 34326 34328 34332 34338 34344 34346 34352 34356 34358 34364 34368 34374 34382 447348
 4NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO
4NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO
 a.硝酸浓度越大越易分解,致使浓硝酸呈黄色;
a.硝酸浓度越大越易分解,致使浓硝酸呈黄色; a.大多数金属(除Au、Pt外)+ HNO3(无论浓稀)=高价态
a.大多数金属(除Au、Pt外)+ HNO3(无论浓稀)=高价态
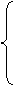 氢以后的金属+ HNO3 = 硝酸盐+
氢以后的金属+ HNO3 = 硝酸盐+
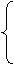 硝酸
NO2(浓HNO3)
硝酸
NO2(浓HNO3) 
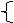 3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O