摘要:硝酸的性质1. 计算 (1)电子守恒法确定还原产物
网址:http://m.1010jiajiao.com/timu3_id_342855[举报]
Cu在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HN03(稀)═3Cu(NO3)2+2NO↑+4H20将3.84g Cu中加入100mL稀HNO3溶液,恰好完全反应,计算(请写出计算过程).
(1)生成NO在标准状况下的体积.
(2)反应中稀硝酸所体现的性质是?则被还原的稀硝酸HNO3的物质的量.
(3)反应前稀HNO3溶液中溶质的物质的量浓度.
查看习题详情和答案>>
(1)生成NO在标准状况下的体积.
(2)反应中稀硝酸所体现的性质是?则被还原的稀硝酸HNO3的物质的量.
(3)反应前稀HNO3溶液中溶质的物质的量浓度.
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是
sp3
sp3
;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为
N>P>As
N>P>As
;(3)As原子序数为
33
33
,其核外M层和N层电子的排布式为3s23p63d104s24p3
3s23p63d104s24p3
;(4)NH3的沸点比PH3
高
高
(填“高”或“低”),原因是NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力
NH3分子间存在较强的氢键,而PH3分子间仅有较弱的范德华力
.PO43-离子的立体构型为
正四面体
正四面体
;(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13.硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因
第一步电离出的氢离子抑制第二步的电离
第一步电离出的氢离子抑制第二步的电离
;②硝酸比亚硝酸酸性强的原因
硝酸中N呈+5价,N-O-H中O的电子更向N偏移,导致其越易电离出氢离子
硝酸中N呈+5价,N-O-H中O的电子更向N偏移,导致其越易电离出氢离子
;(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为
| ||
| 2 |
| ||
| 2 |
在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为
1.83×10-3
1.83×10-3
g (氧离子的半径为1.40×10-10m)A、B、X、Y、Z为短周期元素,它们的原子序数依次增大;A是自然界中组成化合物种类最多的元素之一:B元素的最高价氧化物对应的水化物与其简单氢化物反应生成一种盐G;元素A与Y同主族,且Y元素在短周期元素中的原子半径最大(不考虑稀有气体);Z元素的核电荷数是X的2倍.请回答下列问题:
(1)盐G的晶体内所含化学键类型是 ;在常温下测得该盐的某浓度溶液pH=6,则盐中的阴、阳离子在该溶液中的浓度之差的数值等于 (精确计算);
(2)将元素A与Z形成的化合物与过量NaOH反应生成物质F,F的水溶液在空气中长期放置发生反应,生成M和N两种物质,M与过氧化钠的结构和性质相似,则N的电子式为 ;
(3)有两种化合物同时含有上述元素中的四种相同元素,这两种化合物的水溶液混合后迅速反应,生成物中仍有一种含上述四种元素,写出该产物的化学式: ,该反应的离子方程式是 ;
(4)将由BX和BX2组成的混合气体通入下图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2).
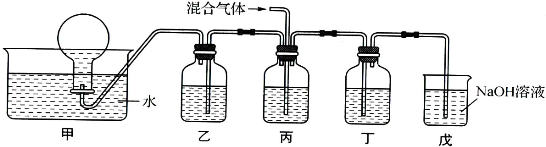
已知:①浓硝酸能将BX氧化成BX2,而稀硝酸不能氧化BX;
②NaOH溶液与BX2能发生反应生成两种盐和水,NaOH溶液与BX不反应.
a.装置乙、丙、丁中盛放的药品依次是 、 、 ;
b.能够说明实验已成功的现象是 .
查看习题详情和答案>>
(1)盐G的晶体内所含化学键类型是
(2)将元素A与Z形成的化合物与过量NaOH反应生成物质F,F的水溶液在空气中长期放置发生反应,生成M和N两种物质,M与过氧化钠的结构和性质相似,则N的电子式为
(3)有两种化合物同时含有上述元素中的四种相同元素,这两种化合物的水溶液混合后迅速反应,生成物中仍有一种含上述四种元素,写出该产物的化学式:
(4)将由BX和BX2组成的混合气体通入下图所示的装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强(在通入混合气体之前,已通入一段时间的N2).

已知:①浓硝酸能将BX氧化成BX2,而稀硝酸不能氧化BX;
②NaOH溶液与BX2能发生反应生成两种盐和水,NaOH溶液与BX不反应.
a.装置乙、丙、丁中盛放的药品依次是
b.能够说明实验已成功的现象是
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
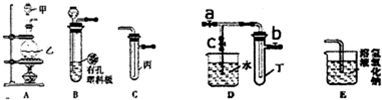
请按要求填空:
(1)如何检查B装置的气密性
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行I、II两个实验,实验操作、现象结论如下:
请你评价实验I、II的结论是否合理?若不合理,请说明理由.
②请利用上述装置设计一个简单的实验,验证C厂和B广的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的化学方程式为
②欲用D装置验证NO2与水的反应(此时c处于关闭状态),其操作步骤为:先关闭止水夹
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是
查看习题详情和答案>>

请按要求填空:
(1)如何检查B装置的气密性
用止水夹夹住橡皮管,向长颈漏斗中加水,若试管中液面不再改变,则装置的气密性良好.
用止水夹夹住橡皮管,向长颈漏斗中加水,若试管中液面不再改变,则装置的气密性良好.
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分成两份,进行I、II两个实验,实验操作、现象结论如下:
| 实验 序号 |
实验操作 | 现象 | 结论 |
| I | 将氯水滴入品红溶液 | 溶液褪色 | Cl2与水反应的产物有漂白性 |
| II | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | Cl2与水反应的产物具有较强的酸性 |
实验Ⅰ结论合理,实验Ⅱ结论不合理,因为制取的氯气中含有氯化氢气体,氯化氢溶于水后能与碳酸氢钠粉末反应产生气泡;
实验Ⅰ结论合理,实验Ⅱ结论不合理,因为制取的氯气中含有氯化氢气体,氯化氢溶于水后能与碳酸氢钠粉末反应产生气泡;
②请利用上述装置设计一个简单的实验,验证C厂和B广的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明氯气的氧化性强于溴,则证明Br-的还原性强于Cl-.
在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液,烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,证明氯气的氧化性强于溴,则证明Br-的还原性强于Cl-.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的化学方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
②欲用D装置验证NO2与水的反应(此时c处于关闭状态),其操作步骤为:先关闭止水夹
ab
ab
再打开止水夹c
c
,使烧杯中的水进入试管丁的操作是双手紧握试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流于试管丁.
双手紧握试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流于试管丁.
.③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是
0.045mol/L
0.045mol/L
(气体按标准状况计算).(2010?金华模拟)如图甲是旧教材中验证铜与浓硝酸反应的装置,乙是新教材对演示实验改进后的装置,丙是某校师生对乙作进一步改进并对所产生的气体的性质进行探究的装置.
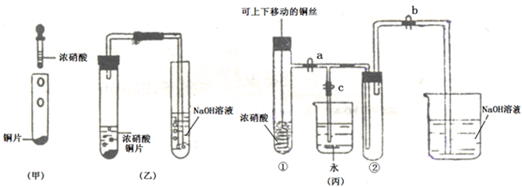
(1)写出铜和浓硝酸反应的化学方程式
(2)与甲装置相比,乙装置的优点是
(3)欲使NO2气体充满试管②,应先
A.颜色 B.平均摩尔质量 C.质量 D.压强E.密度
(4)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是
(5)试管②中的NO2和水充分反应后,所得溶液物质的量浓度最大值是
查看习题详情和答案>>

(1)写出铜和浓硝酸反应的化学方程式
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
.(2)与甲装置相比,乙装置的优点是
无氮的氧化物逸出,可避免环境污染
无氮的氧化物逸出,可避免环境污染
,丙装置除具有乙装置优点外还具有的优点是可使反应随时进行,随时停止
可使反应随时进行,随时停止
.(3)欲使NO2气体充满试管②,应先
关闭弹簧夹c
关闭弹簧夹c
,再打开弹簧夹a和b,当气体充满②后,将铜丝提起与溶液脱离,然后把a、b、c都关闭,并把试管②置于沸水中,则下列各项不变的是CE
CE
.A.颜色 B.平均摩尔质量 C.质量 D.压强E.密度
(4)为了验证NO2与水的反应,欲使烧杯中的水进入试管②的操作是
关闭弹簧夹a和b,打开弹簧夹c,用手捂热试管②一段时间后松开
关闭弹簧夹a和b,打开弹簧夹c,用手捂热试管②一段时间后松开
.(5)试管②中的NO2和水充分反应后,所得溶液物质的量浓度最大值是
0.045mol?L-1
0.045mol?L-1
mol/L.(气体体积按标准状况计算且不考虑实验过程中NO2的损失)