|
硫酸的性质 |
1.将过量的金属投入到含0.200mol的热浓硫酸中,下列判断正确的是( )
A . 因发生“钝化”而不反应 B. 产生的SO2为0.100mol
C. 产生的SO2少于0.100mol D. 除SO2外还会有H2产生
预测4、已知C、D、E、H为气体,反应①是工业生产中的重要反应,反应④⑥⑧是实验室重要的物质检验反应,这些物质有如图所示的转化关系(生成物中的水均已略去)。
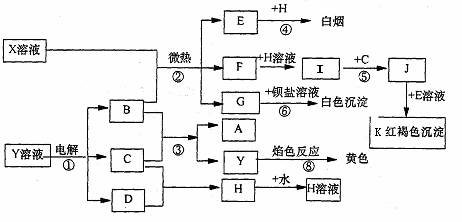
试回答:
(1)写出化学式:K:______ H:_____ (2)反应⑦中A溶液显示的性质是:___________
(填序号:A、氧化性;B、还原性;C、酸性;D、碱性)
(3)若X是一种复盐(不考虑结晶水) X的化学式为:____________
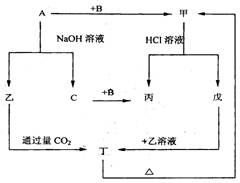 预测5、由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。
预测5、由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。
根据以上的转换关系回答:
(1)写出下列物质的化学式:A ,甲,乙,丁。
(2)写出甲物质在工业上的任两种主要用途
(3)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式。
②乙与过量CO2反应的离子方程式
③戊溶液与乙溶液混合的离子方程式。
高考有机预测(请同学们特别注意官能团保护题)
有机合成中有时会遇到这样的情况,本意只想对某个官能团进行处理,结果却影响了其它官能团。“投鼠忌器”,防止对其它官能的影响,常常采用先保护后恢复的方法。
预测6、工业上用甲苯生产对羟基苯甲酸乙酯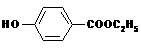 ,其生产过各如下图:
,其生产过各如下图:
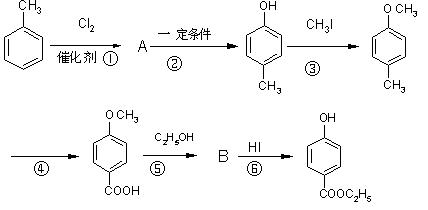
(1)有机物A的结构简式为_____________________。
(2)反应⑤的化学方程式:_____________________________________________。
(3)反应②的反应类型是__________(填编号,下同),反应④的反应类型属_________。
A.取代反应 B.加成反应 C.氧化反应 D.还原反应
(4)反应③的化学方程式:_______________________________________。
(5)在合成线路中,设计第③和⑥这两步反应的目的是:____________________________。
预测7、某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g 。若向此溶液中添加3.5 g氯化钠和6.5 g水,求所得溶液的溶质质量分数。
预测8、A为烃,B为烃的含氧衍生物,由等物质的量的A和B组成的混合物0.05mol在0.125molO2中恰好完全燃烧生成0.1molCO2和0.1molH2O。
(1)通过计算确定该混合物的组合可能有几种?
(2)另取一定量的A和B的混合物完全燃烧,且其中组分以任意比混合且物质的量之和一定。
①若耗氧量一定,则A和B的分子式分别的 、 。
②若生成的CO2和H2O的物质的量一定,则A和B的分子式分别是 、 。
预测9、在400K时,向有机物A的蒸气20mL中充入60mL氧气,引燃恰好完全反应,产生的CO2和H2O(气)的体积比为2:3,冷却到反应前的状况时,混合气体的密度比反应前减少1/5,试通过计算确定该有机物的分子式。
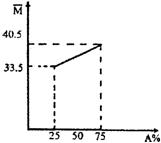 预测10、由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
预测10、由A、B两种物质组成的混合气体,其平均相对分子质量随A的物质的量分数变化关系如右图所示。
(1)A的相对分子质量为 。
(2)若测得混合气体中仅含两种元素,A、B都是无机物时,
化学式分别为 、 ;
A、B都是有机物时,化学式分别为 、 。
(3)某混合气由A、B等体积混合而成,将其与适量氧气混
合,引燃后反应物均无剩余,将产物依次通过足量浓H2SO4
(减少的体积恰好等于消耗氧气的体积、足量碱石灰(体积减半),又知通过浓H2SO4与通过碱石灰所减少的气体体积之比为5∶2。气体体积均在105℃和1.01×105Pa条件下测定的,据此确定混合气体的组成。
预测11、A、B、C为三种链烃,其碳原子数有如下组合:
|
组 别 |
碳原子数 |
||
|
A |
B |
C |
|
|
① |
3 |
3 |
6 |
|
② |
3 |
3 |
4 |
|
③ |
1 |
4 |
5 |
|
④ |
2 |
4 |
4 |
|
⑤ |
5 |
2 |
7 |
|
⑥ |
2 |
2 |
4 |
试回答下列问题:
(1)若B、C为烷烃,且在一定条件下C可分解(裂化)为A和B,则满足此条件的可能组别是(填组别序号) 。
(2)若组别⑥中A为烷烃,B为炔烃,C为烯烃,且A、B、C三种物质按物质的量1:1:2混合,取标准状况下该混合物和过量O2组成的混合气体840mL,电火花点燃,将燃烧后的产物用过量碱石灰吸收,碱石灰增重0.93g。求:碱石灰吸收后所剩气体在标准状况下的体积。
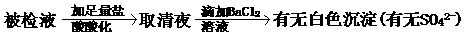
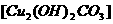 的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成
的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成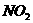 和NO,反应后溶液中
和NO,反应后溶液中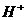 为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求: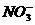 的物质的量浓度(假设反应前溶液的体积不变)。
的物质的量浓度(假设反应前溶液的体积不变)。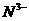 、
、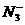 、
、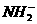 、
、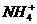 、
、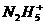 、
、 等,已知
等,已知