0 33934 33942 33948 33952 33958 33960 33964 33970 33972 33978 33984 33988 33990 33994 34000 34002 34008 34012 34014 34018 34020 34024 34026 34028 34029 34030 34032 34033 34034 34036 34038 34042 34044 34048 34050 34054 34060 34062 34068 34072 34074 34078 34084 34090 34092 34098 34102 34104 34110 34114 34120 34128 447348
 zC的可逆反应达到平衡。
zC的可逆反应达到平衡。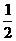 Cl2(g) →NaCl(s); △Q1
Cl2(g) →NaCl(s); △Q1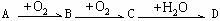 。
。